2023年2月2日
細胞膜研究室の平林哲也主席研究員は東京大学の村上誠教授らとの共同研究で「肝臓の細胞膜から重要な栄養素コリンを取り出す仕組みを発見」についてCell Reports に発表しました。
肝臓の細胞膜から重要な栄養素コリンを取り出す仕組みを発見
発表者
| 村上 誠 | 東京大学大学院医学系研究科 附属疾患生命工学センター 健康環境医工学部門 教授 |
| 平林哲也 | 東京都医学総合研究所 細胞膜研究室 主席研究員 |
- <論文名>
- “Hepatic Phosphatidylcholine Catabolism Driven by PNPLA7 and PNPLA8 Supplies Endogenous Choline to Replenish the Methionine Cycle with Methyl Groups ”
- <発表雑誌>
- Cell Reports 2023; 42, 111940.(オンライン版:1月30日)
DOI: 10.1016/j.celrep.2022.111940
- <著者>
- Tetsuya Hirabayashi#*, Mai Kawaguchi#, Sayaka Harada#, Misa Mouri, Rina Takamiya, Yoshimi Miki, Hiroyasu Sato, Yoshitaka Taketomi, Kohei Yokoyama, Tetsuyuki Kobayashi, Suzumi M. Tokuoka, Yoshihiro Kita, Emiko Yoda, Shuntaro Hara, Kyohei Mikami, Yasumasa Nishito, Norihito Kikuchi, Rieko Nakata, Mari Kaneko, Hiroshi Kiyonari, Kohji Kasahara, Toshiki Aiba, Kazutaka Ikeda, Tomoyoshi Soga, Makoto Kurano, Yutaka Yatomi, and Makoto Murakami*
#共同筆頭著者、*責任著者
発表のポイント
- 肝臓の細胞膜リン脂質から必須栄養素であるコリンを取り出す新たな代謝経路を発見しました。
- リン脂質分解酵素であるPNPLA7またはPNPLA8の欠損により、肝臓の遊離型コリンが減少するとともに、コリンのメチル基を利用したメチオニンの再生が低下することで、コリンとメチオニンの欠乏症によく似た症状を発症することを明らかにしました。
- 本研究の成果により、コリンやメチル基の不足によって起きる疾患の病態解明と、これらの脂質分解酵素を標的とした新規治療法の開発が期待されます。
発表概要
東京大学大学院医学系研究科 附属疾患生命工学センター 健康環境医工学部門の村上誠教授、東京都医学総合研究所 細胞膜研究室の平林哲也主席研究員らの研究グループは、慶應義塾大学、昭和大学などと共同で、「肝臓のリン脂質に貯蔵されるコリン(注1)を取り出す新たな代謝経路」を発見しました。コリンは、発育、肝機能、認知機能、中性脂質の輸送などに重要な栄養素であり、肝臓において必須アミノ酸のメチオニンの再生にも利用されます。本研究成果は、コリンを体内でリサイクルする仕組みとその意義を解明した画期的な成果であることから、米国の医学・生物学を扱うセル出版(Cell Press)が発行する学術雑誌『Cell Reports(セル・リポーツ)』のオンライン版に2023年1月30日(米国東部時間)に公開されました。
発表内容
1) 研究の背景
コリンは体にとって非常に大切な栄養素であり、細胞膜、神経伝達物質などの合成に利用されます。さらには肝臓では、コリンに含まれるメチル基を利用して、様々な生命応答に利用される必須アミノ酸であるメチオニンを再生する回路(メチオニン回路(注2))が備わっており(図1)、コリンはメチル基の重要な供給源でもあります。また、コリンが不足すると中性脂質が肝臓に蓄積して脂肪肝になることも知られています。このように、コリンは、認知機能、肝機能、中性脂質の輸送などに重要な栄養素であることから、コリンやメチオニンは、家畜の飼料をはじめ、一部の粉ミルクやペットフードにも添加・配合されています。また、欧米やアジアではコリン摂取量の目安を設定する国が増えており、米国では必須栄養素として指定されています。一方で、高濃度のコリンはそのままの形(遊離型)では有害であるため、余剰のコリンを別の形で貯蔵し、必要に応じて貯蔵場所から取り出して使用し、使い終わった後にリサイクルする仕組みが必要です。実際、細胞内では遊離コリンの濃度は低く保たれており、生体内に存在するコリンの95%以上は細胞膜の主要構成要素であるホスファチジルコリン(注3)と呼ばれるリン脂質に貯蔵されています。しかしながら、この細胞膜に貯蔵されたコリンを取り出す酵素の正体はこれまでよく分かっていませんでした。
2) 研究内容
肝臓では、ホスファチジルコリンからコリンを取り出す際に、ホスファチジルコリン→リゾホスファチジルコリン(注4)→グリセロホスホコリン(注5)→コリンという順序(リン脂質分解経路)で分解が進むことが以前の研究から予想されていました(図1)。ホスファチジルコリンやリゾホスファチジルコリンを分解する酵素には様々なタイプが知られていますが、研究グループは、その中でもホスホリパーゼA2(注6)と呼ばれる脂質代謝酵素群の研究を長年に渡って行ってきました。候補酵素群の遺伝子を欠損する様々なマウスを網羅的に解析した結果、PNPLA7やPNPLA8を持たないマウスの肝臓で、水溶性のグリセロホスホコリンの量が大きく減少しており、それに伴って遊離型コリンの量も減少していました(図2)。さらにはコリンが肝臓のミトコンドリアで酸化されてできるベタイン(注7)や、メチオニンから合成されるS-アデノシルメチオニン(注8)と呼ばれるメチル化反応(注9)に不可欠な化合物も、これらの欠損マウスの肝臓では有意に減少していました(図2)。PNPLA7やPNPLA8の欠損マウスは、成長不良、体脂肪の減少、肝臓から分泌されるリポタンパク質(注10)と中性脂質の減少、血糖値の低下などをはじめとした、コリンやメチオニンの欠乏症によく似た特徴を示しました(図2)。さらに、上述のリン脂質分解経路の中で、PNPLA8は第一段階のホスホリパーゼA2反応(ホスファチジルコリン→リゾホスファチジルコリン)、PNPLA7は第二段階のリゾホスホリパーゼ(注11)反応(リゾホスファチジルコリン→グリセロホスホコリン)に関わることがわかりました。これらの結果から、PNPLA8とPNPLA7によるリン脂質分解反応は、細胞膜のホスファチジルコリンの中に蓄えられたコリンを水溶性のグリセロホスホコリンとして取り出す役割を持ち、さらにこのグリセロホスホコリンがコリンとグリセロール3-リン酸(注12)に分解されて、前者はメチオニン回路へのメチル基の供給に利用され、後者は中性脂質(トリグリセリド)の合成や糖の新生に利用されることが明らかとなりました。
3) 本研究の意義・今後の予定
今回の研究により、PNPLA7とPNPLA8という二つの脂質分解酵素が肝臓の細胞膜に蓄えられたコリンを取り出す役割を担うことを初めて明らかにしました。この経路はメチル基の供給や、肝臓での中性脂質の合成・分泌のみならず、成長、血糖値、体脂肪量などにも関与することが示されました。本研究の成果により、コリンやメチル基の不足によって起きる疾患の病態解明と、これらの脂質分解酵素を標的とした新規治療法の開発が期待されます。
4) 謝辞
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「疾患脂質代謝に基づく生体組織の適応・修復機構の新基軸の創成と医療技術シーズの創出」(研究開発代表者:村上誠、課題番号22gm1210013)、革新的先端研究開発支援事業ステップタイプ(課題番号20gm4010005)、ならびに日本学術振興会科研費(新学術領域研究、基盤研究、挑戦的萌芽研究;課題番号JP15H05905、JP15K15094、 JP16H02613、JP18H05025、JP18K06978、JP19K22483、JP20H05691)の支援により実施されました。
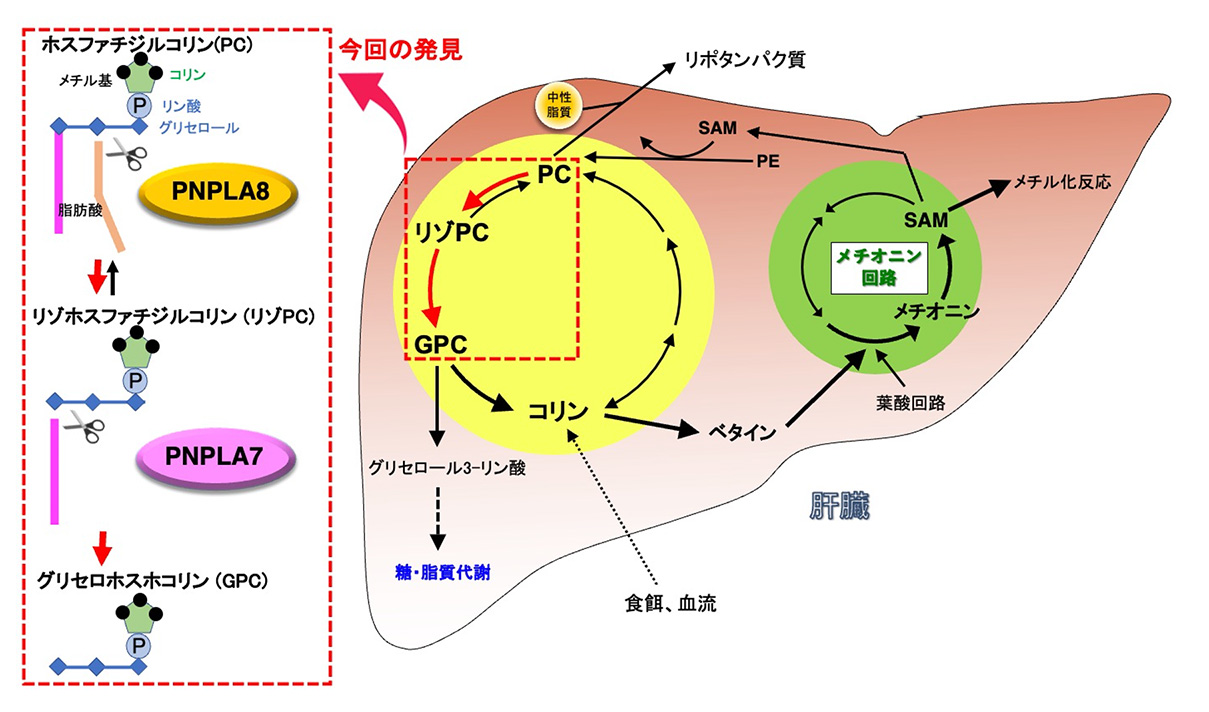
図1 肝臓におけるコリン・メチオニン代謝
肝臓では細胞膜の主要構成成分であるホスファチジルコリン(PC)にコリンが大量に貯蔵されているが、PCを分解してコリンを取り出す酵素群はこれまで見つかっていなかった。本研究により、PCに二つ結合する脂肪酸のうちの一つがホスホリパーゼA2活性を持つPNPLA8によって切り取られてリゾPCとなり、さらにもう一つの脂肪酸がリゾホスホリパーゼ活性を持つPNPLA7によって切り取られてグリセロホスホコリン(GPC)となることが、それぞれの酵素を欠損するマウスの解析により明らかとなった。GPCはさらにコリンとグリセロール3-リン酸に分解され、コリンはベタインに変換されて、メチオニン回路にメチル基を供給するのに利用される。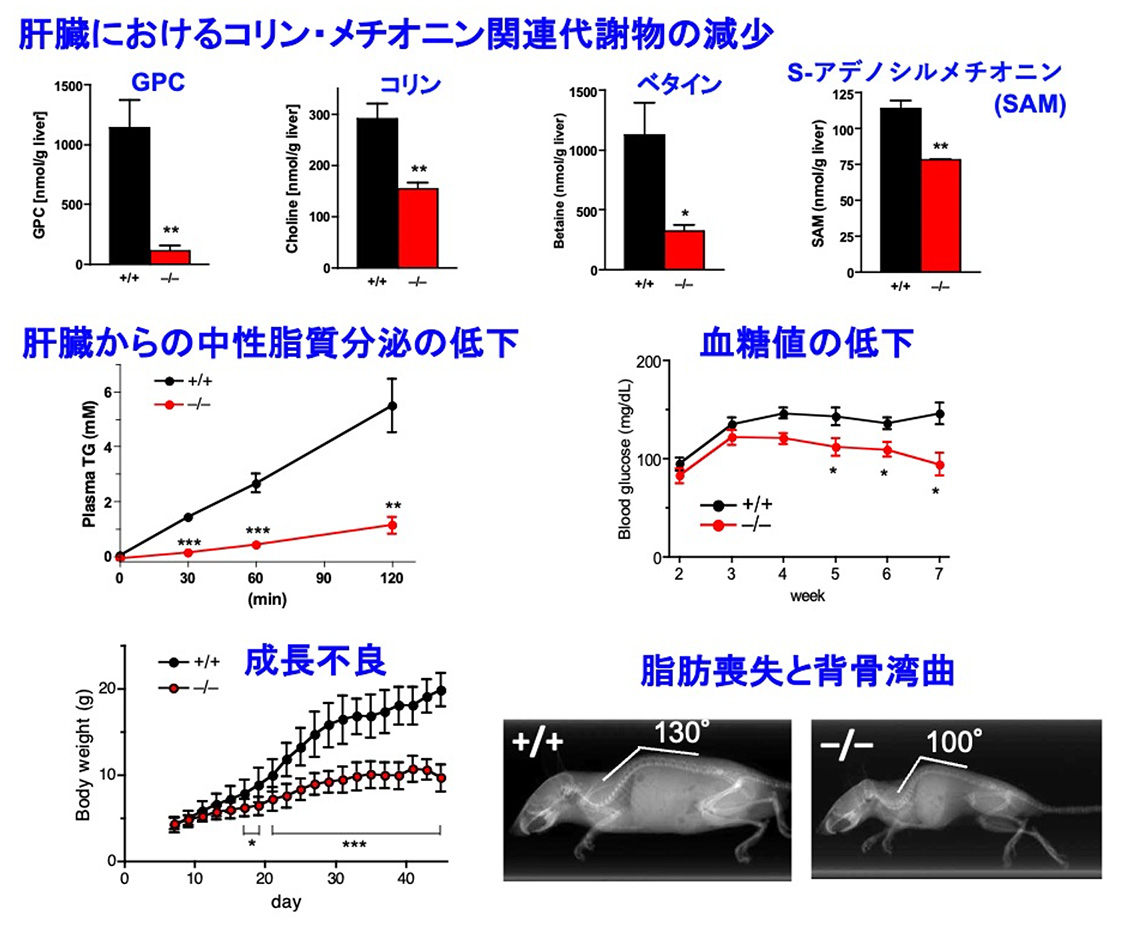
図2 全身性Pnpla7欠損マウスの主な表現型
(上段) PNPLA7をコードする遺伝子を欠損したマウス (–/–.赤) は、6週齢の肝臓に含まれるグリセロホスホコリン(GPC)、コリン、ベタイン、S-アデノシルメチオニン(SAM)などのコリン・メチオニン関連代謝物の量が、野生型(+/+.黒)と比べて減少していた。(中段) この欠損マウスでは肝臓からのリポタンパク質を介した中性脂質(トリグリセリド)の分泌の低下、血糖値の低下などが見られた。
(下段) この欠損マウスは、成長不良、脂肪組織の縮小、背骨の彎曲などの表現型を示した。
これらの変化に関しては、PNPLA8を欠損したマウスでも同様の傾向が見られた。*p<0.05, **p<0.01, *** p<0.001
<用語解説>
- (注1)コリン
- 水溶性のビタミン様の栄養素で、細胞膜を主要構成成分であるホスファチジルコリンや、神経伝達物質のアセチルコリンの原材料となる。肝臓以外の臓器ではほとんど作られず、コリンの欠乏は肝機能の低下や脂肪肝を引き起こす。米国では必須栄養素として指定され、1日の摂取目安量が設定されている。
- (注2)メチオニン回路
- メチオニン→S-アデノシルメチオニン→S-アデノシルシステイン→ホモシステイン→メチオニンという反応過程で成り立つ代謝経路。メチオニンと ATP の反応で生成した S-アデノシルメチオニン(SAM)はメチル基供与体として働いた後、メチル基を失って S-アデノシルホモシステインを生じる。これが加水分解されてホモシステインができる。ホモシステインは毒性が高いため、再メチル化によりメチオニンに戻るか、イオウ転移経路により代謝されて消去される。ホモシステインをメチオニンに変換する際のメチル基の供給源として、葉酸回路が生体内の細胞に普遍的に存在するが、肝臓ではメチル基を大量に消費するため、コリンからもベタインを経てメチル基が供給される。
- (注3)ホスファチジルコリン
- 細胞膜の主要構成成分であり、中性脂質やコレステロールの輸送にも関与する。グリセロール骨格の1位と2位に脂肪酸がエステル結合しており、3位にはリン酸を介してコリンが結合している(図1)。卵黄、レバー、大豆に多く含まれており、細胞内においてケネディ経路という代謝経路で遊離コリンから合成されるのに加え、肝臓では近縁のリン脂質であるホスファチジルエタノールアミンのメチル化によっても合成される。
- (注4)リゾホスファチジルコリン
- ホスファチジルコリンの二つの脂肪酸のうち一つが加水分解により切断された分子。
- (注5)グリセロホスホコリン
- リゾホスファチジルコリンからさらにもう一つ脂肪酸が加水分解により切断されて生じる水溶性分子。細胞内や母乳中に高濃度で存在し、栄養学的には成長ホルモン分泌促進、認知症改善、肝機能障害改善、腎臓や精巣での浸透圧調節などの作用があるとされる。
- (注6)ホスホリパーゼA2
- リン脂質のグリセロール骨格の2位のアシル結合を加水分解して脂肪酸とリゾリン脂質を遊離する酵素群の総称。哺乳動物では50種類以上のホスホリパーゼA2分子種が存在し、それぞれが特有の生命応答に関わることが明らかとなってきている。
- (注7)ベタイン(トリメチルグリシン)
- アミノ酸であるグリシンのアミノ基に三つのメチル基が結合した構造を持つ(そのためトリメチルグリシンとも呼ばれる)。食事に含まれる他に、肝臓ではコリンの酸化によっても生じ、肝臓のメチオニン回路にメチル基を供給する働きがある。
- (注8)S-アデノシルメチオニン(SAM)
- メチル化反応におけるメチル基供与体として主に機能し、メチオニンとATP(アデノシン2リン酸)から合成される。タンパク質、DNA、脂質などさまざまな生体分子のメチル化反応に利用される。
- (注9)メチル化反応
- メチル基(CH3:炭素原子1、水素原子3)の受け渡しを意味する化学用語。生体内ではSAMのメチル基がタンパク質、DNA、脂質などさまざまな生体分子に転移される。
- (注10)リポタンパク質
- 血液中において水に溶けない脂質を運搬するための複合体粒子。 粒子の外側には親水性のリン脂質や遊離コレステロール、アポリポタンパク質が、粒子の内側には疎水性のコレステロールエステルや中性脂肪の脂質成分が存在する。粒子の大きさ、比重の違いにより主要4分画に分類され、そのうち肝臓で合成された中性脂質を他の組織に運搬するリポタンパク質はVLDL(Very Low Density Lipoprotein)と呼ばれる。
- (注11)リゾホスホリパーゼ
- 脂肪酸を一つ持つリゾリン脂質を加水分解して、脂肪酸と水溶性代謝物であるグリセロホスホジエステルを生じる酵素群。リゾホスファチジルコリンを加水分解した場合はグリセロホスホコリンを生じる。
- (注12)グリセロール3-リン酸
- グリセロールは中性脂質やリン脂質の骨格として使用されており、グリセロールの3位にリン酸が結合した分子がグリセロール3-リン酸である。リン脂質の新規合成の出発物質であるとともに、酸化されると解糖系の中間代謝物であるジヒドロキシアセトンリン酸(DHAP)となる。したがって、グリセロールやグリセロール3-リン酸は、中性脂質、リン脂質、糖などの代謝を繋ぐ鍵となる化合物と言える。
