2023年4月24日
感染制御プロジェクトの山根大典主席研究員、松本萌協力研究員(現東京大学大学院修士課程)、篠﨑ことみ協力研究員らの研究グループは「恒常的にウイルス感染を抑制する自然免疫の仕組みを発見」についてNucleic Acids Research に発表しました。
恒常的にウイルス感染を抑制する自然免疫の仕組みを発見
当研究所感染制御プロジェクトの山根大典主席研究員、松本萌協力研究員(現東京大学大学院修士課程)、篠﨑ことみ協力研究員らの研究グループは、宿主細胞が恒常的にウイルス感染を抑制する自然免疫の仕組みを明らかにしました。ウイルスが感染の標的とする宿主細胞は、ウイルスの侵入を感知して活性化する「応答性」のシグナルに加えて、恒常的に抗ウイルス状態を維持する「基底レベル」のシグナルによって抗ウイルス防御層を形成しています。しかしながら、恒常的な防御層を制御するシグナル伝達の仕組みの詳細はわかっていませんでした。本研究では、様々な細胞に広く存在しているタンパク質であるCSNK2Bが恒常的な抗ウイルス防御層の維持に重要な役割を担うことを明らかにしました。
研究成果は、2023年4月24日に英国科学誌「Nucleic Acids Research」にオンライン掲載されました。
- <論文名>
- “CSNK2B modulates IRF1 binding to functional DNA elements and promotes basal and agonist-induced antiviral signaling”
- <著者名>
- Moe Matsumoto#, Jennifer L. Modliszewski#, Kotomi Shinozaki#, Reona Maezawa, Vincent M. Perez, Yuki Ishikawa, Ryosuke Suzuki, Kevin L. McKnight, Takahiro Masaki, Asuka Hirai-Yuki, Michinori Kohara, Stanley M. Lemon, Sara R. Selitsky, and Daisuke Yamane*
#共同筆頭著者、*責任著者 - <発表雑誌>
- 英国科学誌 Nucleic Acids Research (2023年4月24日オンライン掲載)
DOI: 10.1093/nar/gkad298
研究の背景
研究グループは、ウイルス感染防御に働く自然免疫の仕組みに注目した研究をこれまで展開しており、宿主細胞に存在する転写因子の一つであるインターフェロン制御因子1(IRF1)が、恒常的に抗ウイルス遺伝子の発現を誘導し、ウイルス感染を強力に抑制することを報告しました(Nat Microbiol. 2019 4:1096-1104.)。IRF1は、肝疾患の原因となる様々な肝炎ウイルスのみならず、熱帯病ウイルスであるデングウイルスやジカウイルスを含む広範なウイルスに対して抑制能をもちますが、IRF1の機能がどのような細胞内因子によって制御されているのかについては不明でした。
研究の概要
IRF1の抗ウイルス機能を制御する細胞因子を探索するため、細胞内においてIRF1に直接結合するタンパク質を分離し、それらの中でIRF1の転写活性に影響を与えるものを調べました。その結果、様々なタンパク質をリン酸化する酵素であるカゼインキナーゼ2(CK2)複合体の構成要素として知られているCSNK2Bの発現量が低下した細胞ではIRF1の機能が有意に減弱することがわかりました。
CSNK2BがIRF1の転写機能をどのように制御しているのかについて、全ゲノム解析によって調べたところ、CSNK2Bを欠損した細胞においては多くの抗ウイルス遺伝子(PLAAT4, ERAP2など)のプロモーター領域へのIRF1の結合が半減することが判明しました。このようにCSNK2Bが存在しない状況では、IRF1の標的DNA配列に対する結合親和性の減弱が認められますが、一方でAFAP1というアクチン結合タンパク質をコードしているDNA領域へのIRF1の結合が例外的に増加することを見出しました。通常、IRF1のプロモーター領域への結合は転写を活性化しますが、AFAP1領域においてはIRF1の結合が増加することで転写が抑制されることがわかりました。これらの結果から、CSNK2BはIRF1のDNA結合親和性を変化させることで、IRF1制御下にある遺伝子発現を促進する機能をもつことが明らかになりました。
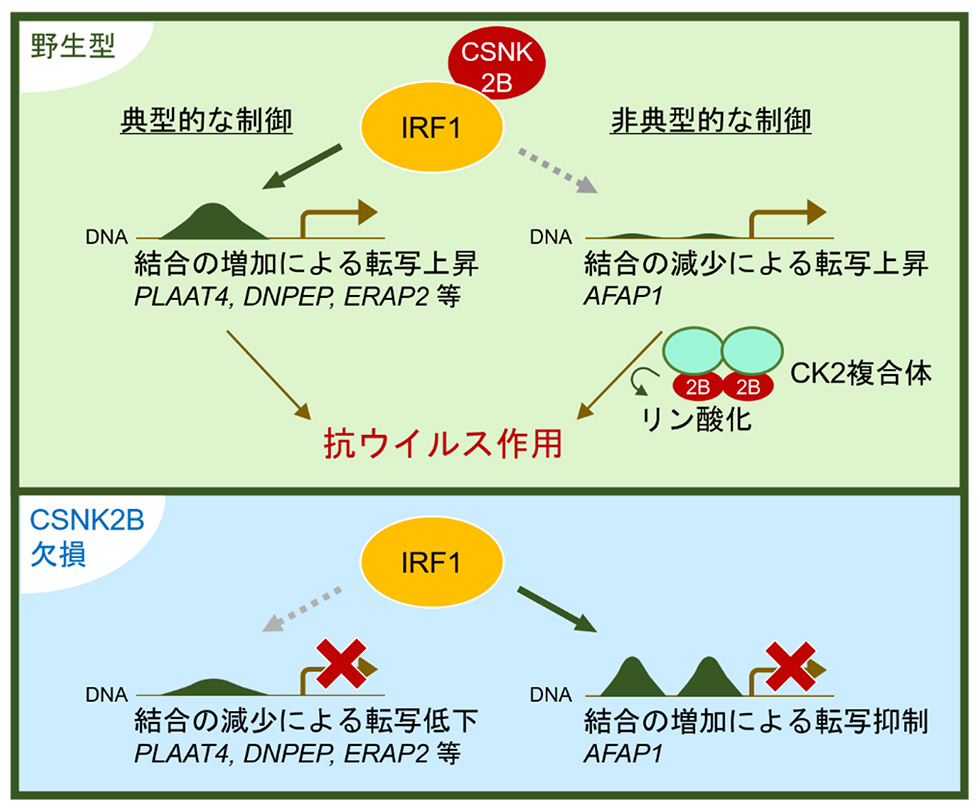
本研究においてCSNK2BとIRF1によって制御される遺伝子として新たに見出したAFAP1は、これまで特定のがん細胞の増殖を促進する因子として知られていました。AFAP1が様々なウイルスの増殖に与える影響を調べたところ、デングウイルスの増殖を抑制する作用があることを発見しました。デングウイルスやジカウイルスを含むフラビウイルスは細胞内のアクチン骨格を複製の場に利用することから、AFAP1はアクチンに強固に結合することでウイルスがアクチン骨格を利用しにくくしている可能性が考えられます。
CSNK2BはAFAP1の転写を促進することがわかりましたが、それだけでなくCK2を介してAFAP1のリン酸化を促進し、がん原遺伝子として知られているSrcの活性化を誘導することも明らかになりました。このように、CSNK2BはAFAP1の転写とリン酸化の2段階で活性化を促進することで、抗ウイルス作用のみならず、がん細胞の増殖においても重要な機能を担っている可能性が示唆されました。CK2の酵素活性を抑制することによってもフラビウイルスの複製が顕著に上昇したことから、CK2は抗フラビウイルス活性をもつことが示され、AFAP1のリン酸化はCK2の抗ウイルス作用機序の一部を担っていると考えられました。
今後の展望
本研究成果により、恒常的な抗ウイルス防御層を維持する分子機構の重要な一面が明らかになりました。しかしながら、CSNK2BがどのようにしてIRF1のゲノムDNAへの結合親和性を変化させているのかについては不明な点が残されており、他の転写因子の関与の可能性を含めて今後解明する必要があります。また、本研究ではCSNK2Bを構成要素とするCK2がAFAP1を介してフラビウイルスの増殖を抑制することを明らかにしましたが、CK2阻害剤は新型コロナウイルスを含む他のウイルスに対しては抑制効果があると報告されています。つまり、CK2は異なるウイルスに対して相反する機能をもつと考えられます。CSNK2BやIRF1が制御する細胞内シグナル伝達機構について今後詳細に解明することで、ウイルス特異的に作用する抗ウイルス薬の開発に繋がることが期待されます。
