2024年5月9日
脳神経回路形成プロジェクトの片山涼香研修生、丸山千秋プロジェクトリーダーらは、「ニワトリ脳発生過程で視床からの神経入力依存的に感覚入力細胞が分化する〜鳥類脳発生過程の新規のメカニズムを解明した論文が掲載〜」について Journal of Comparative Neurology に発表しました。
ニワトリ脳発生過程で視床からの神経入力依存的に感覚入力細胞が分化する
〜鳥類脳発生過程の新規のメカニズムを解明した論文が掲載〜
当研究所脳神経回路形成プロジェクトの片山涼香研修生、隈元拓馬主席研究員、和田京介研修生、丸山千秋プロジェクトリーダーは、早稲田大学総合科学学術院の花嶋かりな教授とともに、鳥類大脳で感覚入力処理を担うEntopallium領域における新規の細胞分化メカニズムを発見しました。本研究成果は国際学術誌『Journal of Comparative Neurology』に2024年5月9日に掲載されました。
- <論文タイトル>
- “Thalamic activity-dependent specification of sensory input neurons in the developing chick entopallium”
(発生期ニワトリ脳Entopallium領域の感覚入力細胞の視床活動依存的な特異化) - <発表雑誌>
- The Journal of Comparative Neurology 2024, 532(6), e25627
DOI:https://doi.org/10.1002/cne.25627
URL:https://onlinelibrary.wiley.com/doi/10.1002/cne.25627
研究の背景
有羊膜類に属する哺乳類と鳥類は、ともに肥大した大脳を持つ動物群です。しかし大脳の細胞構築様式は大きく異なり、哺乳類大脳は層構造の大脳新皮質を、鳥類大脳には核構造の背側脳室稜(DVR)と呼ばれる領域を有しています。鳥類脳DVR内のEntopallium領域には、視床からの視覚情報入力を受ける感覚入力細胞が位置しています。このEntopallium領域の入力細胞は、神経回路や遺伝子発現の特徴から、哺乳類大脳新皮質の第4層と類似性があることが示唆されています。しかし、哺乳類の第4層については、細胞がどのように生まれ、分化していくのかが研究されている一方、Entopallium領域をはじめ、鳥類大脳の各領域の細胞の発生メカニズムはほとんど理解されていませんでした。そこで、本研究では発生期のニワトリ脳で視覚入力を受けるEntopallium領域の入力細胞がどのように産生され分化するのか解析を行いました(図1)
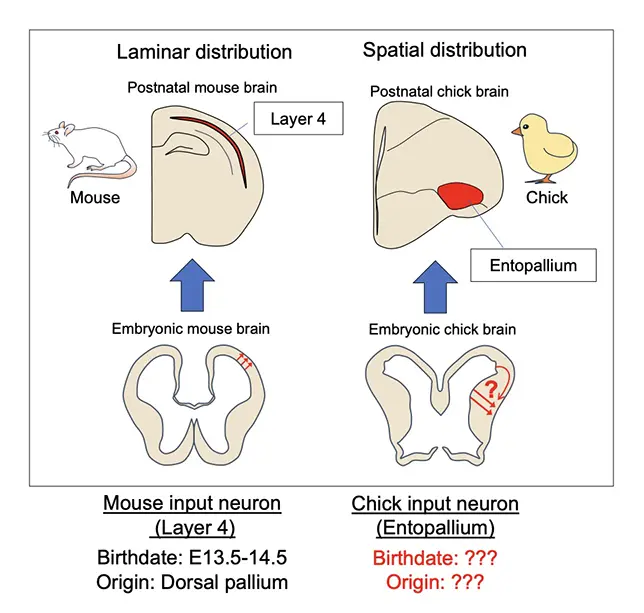
(左)哺乳類大脳新皮質の各層の細胞集団がどのように発生するかはこれまでに研究が進められてきた。(右)哺乳類と比べると、鳥類の脳の核領域ごとの細胞集団がどのように生まれ、分化するのかはほとんど明らかになっていない。
研究の概要
細胞運命を決定する要因には、遺伝子発現などの細胞内的なものと、外部からの刺激入力といった細胞外的なものが考えられます。そこでまず、細胞内的な要素に着目し、Entopallium領域の遺伝子発現パターンの解析や、細胞産生タイミング・細胞産生場所の解析を行いました。
遺伝子発現パターンは、哺乳類の感覚入力を受け取るニューロン層である大脳新皮質第4層で発現することが知られている遺伝子EAG2のin situハイブリダイゼーションにより解析しました。細胞産生タイミングの解析は、細胞を産生時期特異的に標識できるEdUを発生初期のニワトリ胚に投与して行いました。細胞産生位置の解析では、目的遺伝子を細胞のゲノムに挿入することで、導入細胞とそこから生まれた娘細胞を標識し続けることができるiOn スイッチを採用し、in ovoエレクトロポレーションによりニワトリ胚に導入し解析を行いました。
解析の結果、ニワトリ発生期脳のEntopallium領域の細胞集団は、神経産生最初期(発生4日目から5日目)に、lateral pallium、ventral palliumという2つの幹細胞領域から生まれていることが明らかになりました(図2、図4)。その後11日目になると、Entopallium領域でEAG2のmRNAが発現し始め、入力細胞としての性質を獲得することを解明しました。
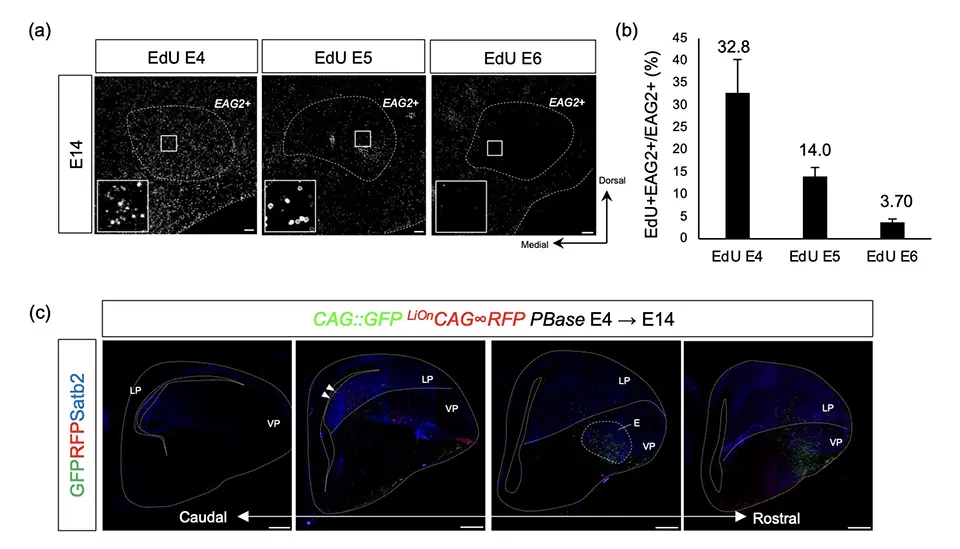
(a) EdU標識によるEntopalliumでの細胞産生時期の解析結果。(b)発生4, 5,6日目にEdUを投与した際のそれぞれのEAG2、EdU共陽性細胞数の定量結果。陽性Entopallium領域の感覚入力細胞は多くが発生4日から5日の間に生まれていた。(c) 細胞系譜解析の結果。Lateral palliumの幹細胞領域の一部(左から2番目、白矢頭)で生まれた細胞が、Entopallium領域に位置している(左から3番目、破線E)。
発生4日から11日までの期間に、どのように入力細胞としての運命が決定されるのでしょうか? Entopallium領域は、視床からの視覚情報の入力を受ける領域であることから、視床からの神経活動の入力という外的な要因が細胞分化に影響しているのではないかと考えました。そこで、視床からEntopalliumへの軸索入力や神経活動入力がどのタイミングで起こるのか、そして活動入力を阻害した場合Entopallium領域の細胞にどのような変化が生じるのかを解析しました。神経軸索トレーサー導入及びカルシウムイメージングを行った結果、視床の軸索入力や神経活動の入力は、EntopalliumでのEAG2の発現が見られるよりも前に生じていました。そこで視床に神経活動を阻害できるKir2.1を導入し、視床からの神経活動入力を阻害すると、EAG2の発現が低下していることが確認でき(図3)、ニワトリ脳Entopalliumの感覚入力細胞への分化には、視床からの神経活動入力が必要であることが初めて明らかになりました。
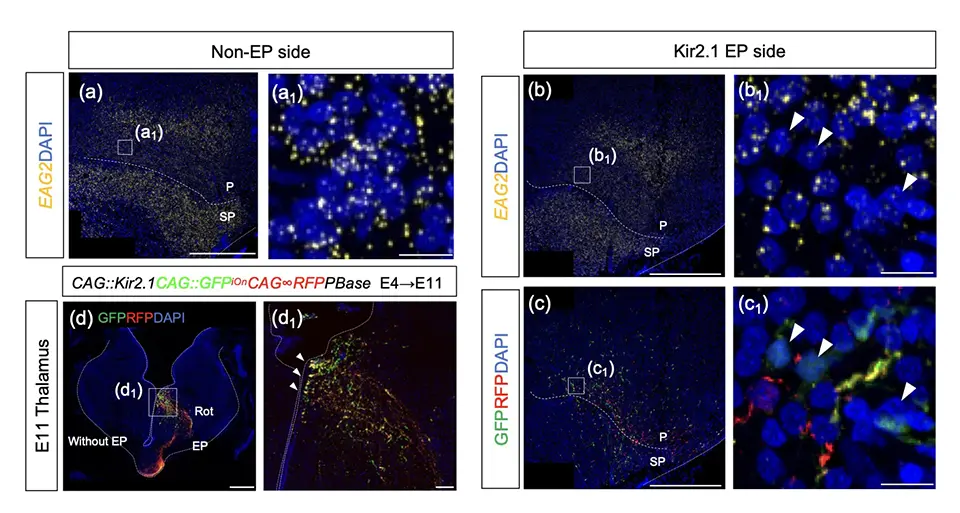
(a)視床にKir2.1を導入していない時のEntopalliumでのEAG2発現。(b)Kir2.1を導入した時のEntopalliumでのEAG2発現。(c)Kir2.1導入時のEntopalliumにおけるGFP陽性、RFP陽性視床軸索の位置。GFP陽性の軸索と接した細胞(白矢頭)では、EAG2の発現が特に低下している。(d)Kir2.1を導入したニワトリ視床の染色図。
今後の展望
本研究により、ニワトリ脳Entopallium領域で視床からの入力を受ける感覚入力細胞は、哺乳類大脳新皮質第4層細胞と同じように、細胞内的作用だけでなく外的作用を受けることによって入力細胞に分化していることがわかりました(図3、4)。鳥類大脳における特定の神経細胞の性質が決定されるメカニズムを世界で初めて明らかにした本研究を起点とし、今後鳥類において他の神経細胞の性質決定メカニズムへの理解も進むと予想されます。異なる脳構造で発展してきた鳥類、哺乳類において、細胞発生メカニズムの共通点や相違点を明らかにしていくことで、生物進化の過程で大脳がどのような進化の変遷を辿ってきたのか、その大きな謎の解明が期待できます。
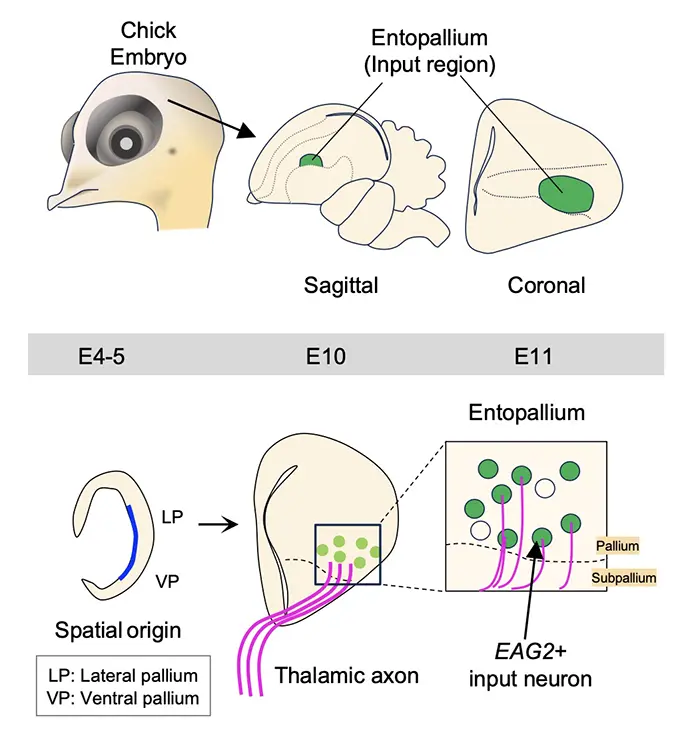
(上)ニワトリ胚を用いてEntopallium領域の入力細胞発生メカニズムを解析した。(下)これらの細胞集団は発生4-5日目にLateral palliumまたはventral palliumで生まれ、視床入力を受けることでEAG2を発現する感覚入力細胞に分化していることが示唆された。
<用語解説>
- 有羊膜類:
- 脊椎動物のうち、石炭期に両生類から分岐した動物群。哺乳類、鳥類、爬虫類が含まれる。
- 感覚入力細胞:
- 哺乳類、鳥類の大脳には感覚情報入力を受ける細胞、感覚情報を大脳の外に出力する細胞、この2つを繋ぐ細胞という、3種類の細胞による神経回路が形成されている。このうち、末梢からの感覚情報入力を初めに受け取る細胞集団のことを感覚入力細胞と呼ぶ。
- in situハイブリダイゼーション:
- 組織上に存在する特定遺伝子のmRNAを標識し、可視化する実験。
- EdU:
- 5-Ethynyl-2’-deoxyuridineの略称。DNA合成時に取り込まれことで、投与時に生まれた細胞だけを標識することができるチミジン・アナログの一種。
- iOn スイッチシステム:
- piggyBacトランスポゾンを用いて目的遺伝子をプラスミドへ導入することで、外来の目的遺伝子を導入細胞のゲノム内に挿入させる遺伝子導入システム。プラスミドを導入するだけでは、細胞分裂していくうちに導入遺伝子の発現量は低下してしまうが、本システムではゲノム内に挿入することによって分裂後の細胞でも目的遺伝子を発現させ続けることができる。
- in ovoエレクトロポレーション:
- 卵中のニワトリ胚の細胞に目的遺伝子のプラスミドベクターを取り込ませるための実験操作。脳室中にベクター等を注入したあと、電圧をかけることによって目的領域の細胞に取り込ませる。
- 神経軸索トレーサー:
- 神経軸索の投射元や投射先を可視化する親油性色素。
- カルシウムイメージング:
- 新鮮な組織を用いて神経細胞のカルシウム濃度変化を解析する実験方法。本研究では、ニワトリ脳切片にカルシウム指示薬を取り込ませてイメージングを行った。
- Kir2.1:
- 内向き整流性カリウムイオンチャネル。過剰発現させることで神経細胞の過分極を引き起こし、神経活動伝達を抑制する。
