2024年9月5日
ゲノム動態プロジェクトの加納豊主席研究員らは共同研究により、「DNA複製フォーク保護複合体が娘染色体に親ヒストンの分配を促しエピジェネティックメモリーを維持している」について Cell に発表しました。
DNA複製フォーク保護複合体が娘染色体に親ヒストンの分配を促し
エピジェネティックメモリーを維持している
当研究所 ゲノム動態プロジェクトの加納豊主席研究員らはコペンハーゲン大学のGeneviève Thon研究グループとの共同研究により、DNA複製フォーク因子であり、複製チェックポイント仲介因子であるMrc1が、遺伝子発現制御の記憶である「エピジェネティックメモリー」を親細胞から娘細胞への継承に重要な役割を担っていることを明らかにしました。なお、本研究は、コペンハーゲン大学のGeneviève Thon博士とゲノム動態プロジェクト研究室の長年の国際共同研究の成果です。筆頭著者のSebastian Jespersen Charlton氏は2022年に、当研究室に3ヶ月間滞在し、共同研究に関する実験を遂行しました。
本研究は、2024年9月5日に「Cell」に発表されました。
- <論文タイトル>
- “The fork protection complex promotes parental histone recycling and epigenetic memory”
(DNA複製フォーク保護複合体は親ヒストンを複製されたDNAに再配置し、エピジェネティックメモリーを促進する) - <著者>
- Sebastian Jespersen Charlton, Valentin Flury, Yutaka Kanoh, Aitana Victoria Genzor, Leonie Kollenstart, Wantong Ao, Peter Brøgger, Melanie Bianca Weisser, Marek Adamus, Nicolas Alcaraz, Charlotte M Delvaux de Fenffe, Francesca Mattiroli, Guillermo Montoya, Hisao Masai, Anja Groth, Geneviève Thon
- <発表雑誌>
- Cell
DOI: 10.1016/j.cell.2024.07.017
URL:https://www.cell.com/cell/fulltext/S0092-8674(24)00777-3
背景
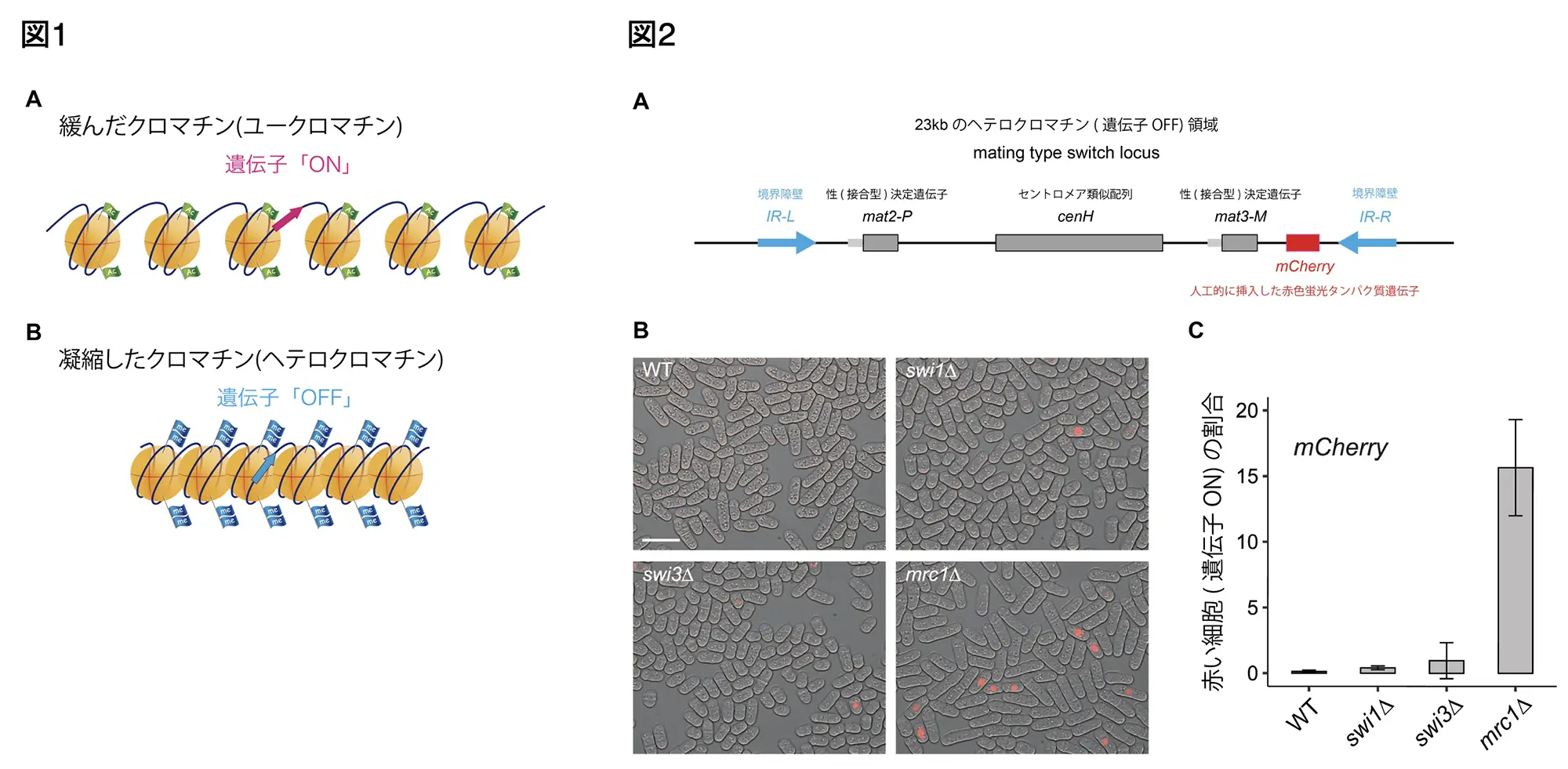
DNAは塩基配列である遺伝情報とともに、「エピゲノム情報*注1」を担います。代表的なエピゲノム情報は、ヒストンの化学的な修飾(メチル化やアセチル化)(図1)により規定され、遺伝子の読み取りの効率を決定します。DNAが複製される際、エピゲノム情報も正確に引き継がれる必要があります。これがうまくいかないと、親細胞と同じ遺伝子の発現パターンを維持できなくなり、細胞の性質が変わってしまう恐れがあります。たとえば、肝臓の細胞は肝臓の機能を担う遺伝子が活性化されていますが、エピゲノム情報が新しい細胞に引き継がれないと、肝臓の細胞としての機能が失われる可能性があります。
私たちの体は多数の細胞で構成されていますが、日々、細胞は分裂して新しい細胞を作り出します。その過程では、まずDNAを正確に複製する必要があります。DNA複製は多くのタンパク質からなる複製フォーク装置によって行われます。この装置の先頭に位置する「複製フォーク保護複合体」であるMrc1Claspin-Swi1Timeless-Swi3Tipin(上付きは哺乳類のホモログを示します)は、DNA複製を効率よく推進させるとともに、途中に異常が発生した際にブレーキの役割を果たし、複製装置の崩壊を防ぎます。これにより、問題が解決した後には速やかにDNA複製が再開できます。
Mrc1Claspinは、進化的に酵母からヒトまで保存され、DNA複製チェックポイント機構の仲介因子として、上流のRad3ATRキナーゼから顆粒のCds1Chk1キナーゼへと複製停止のシグナルを伝え、チェックポイントを活性化します。私たちは、Mrc1分子上にDNA複製開始を制御するHsk1キナーゼ*注2が結合するHBS(Hsk1 bypass segment)を発見しました。Mrc1のHBS欠損(∆HBS)株では、複製チェックポイントは正常だが、チェックポイント非依存的にhsk1変異をバイパスすること見出しまた。また、∆HBSは、複製開始のブレーキが効かなくなっており、初期複製起点のfiringがprematureに起こることを見出しました。私たちは、今回の研究でMrc1の∆HBS変異は、Mrc1欠損株と全く同様に、mating type switch locusのヘテロクロマチン構造*注3を解除することを報告しました。
研究の内容
分裂酵母のmating type switch locusはヘテロクロマチン構造を作っており(図2A)、この中に挿入された遺伝子は転写されずサイレンシングされた状態に維持されます。私たちは、複製フォーク保護複合体のタンパク質群(Mrc1Claspin-Swi1Timeless-Swi3Tipin)の一員のMrc1の欠損株では、サイレンシングが高い頻度で解除されることを見出しました(図2B)。さらに、∆HBS変異株は、欠損株と全く同様に、サイレンシングの解除を示しました。このことから、Mrc1(1019アミノ酸)の、特にHsk1キナーゼの結合領域であるHBS(782-879アミノ酸)が、サイレンシングに必要なエピゲノム情報の継承に必須であることが明らかになりました。
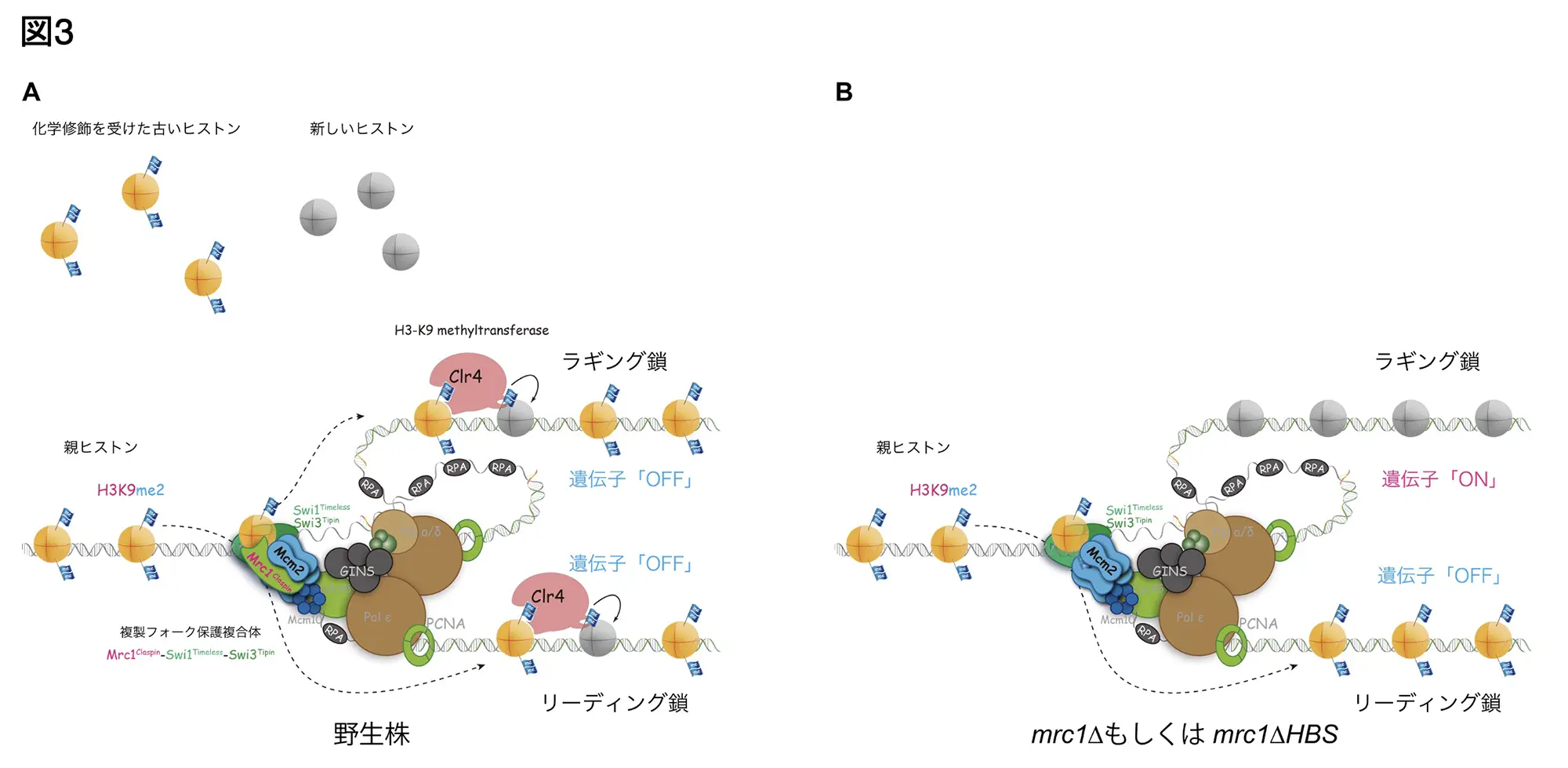
そこで、SCAR-seq*注4という手法により親ヒストンの娘DNA鎖への再配置を検証しました。野生型の細胞では親ヒストンのH3-H4が複製された両方のDNA鎖に均等に分配されていましたが、Mrc1欠損株あるいは、∆HBS株では、親ヒストンはLeading鎖のDNAに蓄積することがわかりました。すなわち、Mrc1は、エピゲノム情報の娘細胞への均等な分配(親ヒストンのラギング鎖への分配)に必要であることが示されました(図3A&B)。
以前に、DNAの2本鎖をほどくDNA複製ヘリカーゼの構成因子であるMcm2タンパク質は、ヒストンの分配、特に、ラギング鎖への分配に必要であることが、報告されています(図3)。そこで、タンパク質の立体構造をAIによって解析するプログラムであるAlphaFold2*注5によってMrc1、Mcm2、ヒストンとの3者の立体構造予測を行ったところ、Mrc1のHBSがヒストンをMcm2に受け渡している可能性が示されました。実際に精製されたタンパク質でこれら3者が複合体を形成するか検証実験を行ったところ、Mrc1はヒストンを介してMcm2に結合していることが証明されました。
今回の研究で、Mrc1は、親から引き継がれたヒストンを複製後の2本の新しいDNA鎖に適切に再配分することで、エピゲノム情報を次の世代に伝達する役割も担っていることを証明しました。この機能はMrc1の哺乳類のホモログであるClaspinにも保存されていることも判明しました。これらの結果から、複製フォークの進行、安定化に関与する複製フォーク保護複合体は、エピゲノム情報の継承においても、複製ヘリカーゼと共同し、重要な役割を果たしていることが明らかになりました。
発表のポイント
- 1. DNA複製時のヒストン再利用
- ヒストンには遺伝子のオン・オフを示す化学的修飾があり、これにより遺伝子の発現を制御します。修飾を受けたヒストンが「親ヒストン(parental histone)」(図2)です。親ヒストンを新たに複製されたDNAに再利用・分配することで、細胞の遺伝子発現の記憶を維持します。
- 2. 複製フォーク保護複合体の役割
- 複製フォーク保護複合体は、DNA複製の効率の良い進行を促進するとともに、複製が予期せず停止した際、それを認識し、複製フォークを安定化し、DNAに傷がつくことを防ぎます。今回の発見は、複製フォーク保護複合体(図2)は、親ヒストンの新たに複製されたDNA鎖への再配置に重要な働きをすることを示しました。これにより、新しいDNA鎖にも親ヒストンの化学的修飾が引き継がれ、細胞は遺伝子発現パターンを維持し、細胞の性質を保つことができます。
- 3. エピジェネティックメモリーの維持
- 複製フォーク保護複合体が正常に機能することで、親ヒストンが適切に再利用され、細胞のエピゲノム記憶が維持されます。これにより、細胞は遺伝子のオン・オフの状態(図1)を記憶し、次世代の細胞にも正しく引き継ぐことが可能です。
この研究は、DNA複製の進行とモニタリングに関与する複製因子が、DNA情報だけでなくヒストンを介したエピゲノム情報*注1の継承にも重要な役割を果たすことを初めて示しました。複製フォークの進行阻害に対する細胞応答の不全は、細胞癌化に直接的に関与することが知られており、複製フォーク保護因子はその中で中心的な役割を担うことが知られていました。今回の発見は、この因子がゲノム情報のみでなくエピゲノム情報の伝達を介して、ゲノム安定性の維持に関与することを示すもので、がんなどの疾患発生のメカニズムに新規な洞察を与え、がん治療の新たな戦略を示唆します。
研究の意義
この研究は、細胞がどのようにしてエピゲノム情報を維持、継承する過程における、複製フォーク保護複合体、特にMrc1/Claspinの役割とそのメカニズムを解明しました。このメカニズムは、ゲノム上のサイレンシング状態の維持に必須な役割をはたします。
社会的意義
エピゲノム情報の維持と継代は、発生、癌化、老化などにおいても重要な役割を果たします。したがって、そのメカニズムの解明は、細胞の運命決定や疾患(がんや発達障害など)の理解を深めるのに寄与し、疾患の治療の新規な標的を提示し、疾患の予防、診断、治療に貢献します。
注釈
- *注1: エピゲノム情報はDNAの塩基配列には変化を加えずに、遺伝子の発現や機能を調整する化学修飾。エピゲノム修飾には主にヒストンのメチル化・アセチル化等の化学修飾やDNAのシトシン塩基のメチル化があります。
- *注2: Hsk1キナーゼはタンパク質にリン酸基を付与することでDNA複製開始を触媒する、進化的に酵母からヒトまで保存されるCdc7キナーゼの分裂酵母ホモログ。
- *注3: クロマチン構造にはユークロマチン状態とヘテロクロマチン状態があります。ユークロマチンは比較的緩く巻かれているクロマチンで、含まれる遺伝子は一般に活性化されており、転写が行われています。ヘテロクロマチンは緊密に凝縮しているクロマチンで、転写因子がアクセスしにくいため、ヘテロクロマチンに含まれる遺伝子は不活性化(サイレンシング)されています。
- *注4: SCAR-seq(Sister Chromatid After Replication sequencing)法は、新しく複製されたDNAにどのような修飾を受けたヒストンが結合していたかを解析する手法で、エピジェネティック情報が娘染色分体に引き継がれるかを調べることができます。
- *注5: AlphaFold2はタンパク質の立体構造を予測するための人工知能(AI: artificial intelligence)技術です。これまで多くの研究者によって決定されてきたタンパク質の構造の膨大なデータを学習するよって、構造が決定されていないタンパク質の構造を予測します。この技術の開発によって、ハサビス氏とジャンパー氏が2024年のノーベル化学賞を受賞しています。
