2024年10月12日
基礎医科学研究分野の田中智子、精神行動医学研究分野の岡戸晴生らは、「ミノサイクリンで加齢による認知機能低下を予防:RP58遺伝子に着目した発見」について Journal of Neuroinflammation に発表しました。
ミノサイクリンで加齢による認知機能低下を予防:RP58遺伝子に着目した発見
当研究所 基礎医科学研究分野の田中智子、吉種光、精神行動医学研究分野の岡戸晴生、平井志伸、新保裕子、病院等連携支援センターの遠藤堅太郎、基盤技術支援センターの西藤泰昌、学術支援室の堀内純ニ郎、奈良県立医大の眞部寛之により、ZBTB18/RP58ハプロ不全(注1)関連知的障害モデルマウスであるRp58ヘテロ欠損マウスが、加齢による空間認知機能の早期低下を示すこと、その原因が海馬歯状回の苔状細胞(注2)のDNA損傷蓄積、ミクログリアの活性化、慢性炎症であると推察され、ミノサイクリンにより予防できることを見出しました。
これらの成果は、RP58/ZBTB18ハプロ不全患者の病態機序解明と予防治療法開発、さらに加齢性認知機能低下の防止に貢献することが期待されます。
本研究成果は、2024年10月12日(土曜日)に英国科学誌『Journal of Neuroinflammation』にオンライン掲載されました。
- <論文タイトル>
- “Minocycline prevents early age-related cognitive decline in a mouse model of intellectual disability caused by ZBTB18/RP58 haploinsufficiency”
- <著者>
- Tomoko Tanaka*, Shinobu Hirai, Hiroyuki Manabe, Kentaro Endo, Hiroko Shimbo, Yasumasa Nishito, Junjiro Horiuchi, Hikari Yoshitane and Haruo Okado*
- <発表雑誌>
- Journal of Neuroinflammation
DOI: 10.1186/s12974-024-03217-1
URL:https://link.springer.com/article/10.1186/s12974-024-03217-1
ポイント
- 転写抑制因子RP58の変異により生じる知的障害患者のモデル動物であるRp58ヘテロ欠損マウスを解析し、早期の加齢による空間認知期機能の低下を明らかにした。
- 上記モデルマウスの組織学的解析により、海馬歯状回の苔状細胞におけるDNA損傷蓄積、ミクログリアの活性化を見出した。
- ミノサイクリンの慢性投与により、当該モデルマウスで認められた上記症状を防ぐことができた。これらの発見により、ミノサイクリン慢性投与は、RP58ハプロ不全患者の加齢性認知機能低下の、新たな予防法と考えられるとともに、生理的な加齢性認知機能低下の新たな予防法としても期待される。
研究の背景
知的障害は神経発達障害のひとつであり、知的機能および適応機能の障害が発達期に始まります。知的障害は、様々な環境要因:外傷、神経障害、栄養障害、代謝障害によって惹起されます。遺伝的要因もまた、知的障害の主な原因です。1q43q44微小欠失症候群(注3)は知的障害を呈し、ジンクフィンガーおよびBTBドメイン含有タンパク質18(ZBTB18/ZNF238/ZFP238/RP58、以下RP58)は、1q43q44微小欠失症候群の原因遺伝子産物の一つとして同定されています。RP58は、N末端にBTBドメイン、C末端に4つのZnフィンガーモチーフを持つ転写制御タンパク質です。知的障害患者のゲノム解析から、RP58遺伝子の多くの切断型変異体やナンセンス変異、ミスセンス変異が見つかっており、RP58のハプロ不全が知的障害の原因であることが知られています。したがって、RP58のハプロ不全に伴う知的障害に対する治療戦略を確立することが重要です。我々は以前にRp58の従来型欠損マウスと条件的欠損マウスを作製し、Rp58が大脳皮質の形成に重要な役割を果たしていることを示しました(文献1)。RP58は新生児の脳で高発現し、その発現は大脳皮質のグルタミン酸作動性神経細胞で脳の成熟後も続きます。我々は以前、Rp58ヘテロ欠損マウスがヒトのRP58ハプロ不全に伴う知的障害のモデルとして機能することを示しました(文献2)。しかし、なぜRP58の異常が知的障害を引き起こすのかは不明です。さらに、この疾患の予防法や治療法も知られていません。
知的障害の患者は、認知症になりやすいことが指摘されています。そこで本研究では、知的障害モデルマウスであるRp58ヘテロ欠損マウスを用いて、成体期における認知機能障害の発現に焦点を当てました。興味深いことに、Rp58ヘテロ欠損マウスは、加齢に伴う空間認知機能障害の加速を示し、このマウスが知的障害に伴う認知症の早期発症モデルとして役立つ可能性が明らかとなりました。また、Rp58ヘテロ欠損マウスは海馬の苔状細胞でのDNA修復不全、DNA損傷の早期蓄積、および海馬におけるミクログリアの炎症応答を示すことから、RP58ハプロ不全の加齢に伴う認知機能障害は、DNA修復不全に伴う慢性炎症によって引き起こされることが示唆されます。中枢神経系は特にDNA損傷修復不全の影響を受けやすく、知的障害を含む様々な神経発達障害や神経変性障害を引き起こすことが知られています。したがって、DNA損傷と炎症を標的とした治療法は、RP58ハプロ不全に関連した病態に有効と考えられました。興味深いことに、神経保護作用と抗炎症作用を持つミノサイクリンにより、Rp58ヘテロ欠損マウスの早期老化に関連した表現型を減弱させることに成功しました。
研究の内容
RP58ハプロ不全は、RP58遺伝子の欠失やミスセンス変異、ナンセンス変異のために、RP58の機能が不十分になることが原因で、知的障害を含む神経発達症(発達障害)を生じると考えられています。本研究では、RP58ハプロ不全が、加齢性の認知機能低下を早期に示すこと、その原因がDNA修復不全によるDNA損傷蓄積の加速、ミクログリアの活性化などの慢性炎症であることが示唆されました。そして、これらの病態をミノサイクリンにより改善させることに成功しました。
主な研究成果6点を以下に示します:
- (1)Rp58ヘテロ欠損マウスは早期に加齢性認知機能低下を示す
- 生後4-5ヵ月の野生型マウスの空間認知機能は、生後2ヵ月のマウスとほぼ同じであったが、生後12-18ヵ月では有意に低く、これは空間学習または記憶の、加齢に伴う障害を示している。一方、Rp58ヘテロ欠損マウスは、生後2ヵ月では野生型マウスと同程度の空間認知機能を示したが、4-5ヵ月齢で有意に低下し、早期の認知機能障害発症を示した。Rp58ヘテロ欠損マウスは、4-5ヵ月齢では、オープンフィールド、ロータロッド、恐怖条件付けテストといった他の行動テストでは有意な行動異常を示さなかったことから、Rp58ヘテロ欠損マウスでは空間学習が特異的に障害されると思われる。海馬CA1領域のシータパワー(注4)を記録し、Rp58ヘテロ欠損マウスの物体認識障害は、シータパワーの低下が学習時にすでに見られることから、記憶の保持や想起というよりもむしろ、物体の位置の学習障害に起因している可能性が示された。
- (2)Rp58ヘテロ欠損マウスでは海馬歯状回の苔状細胞においてDNA損傷が早期に蓄積する
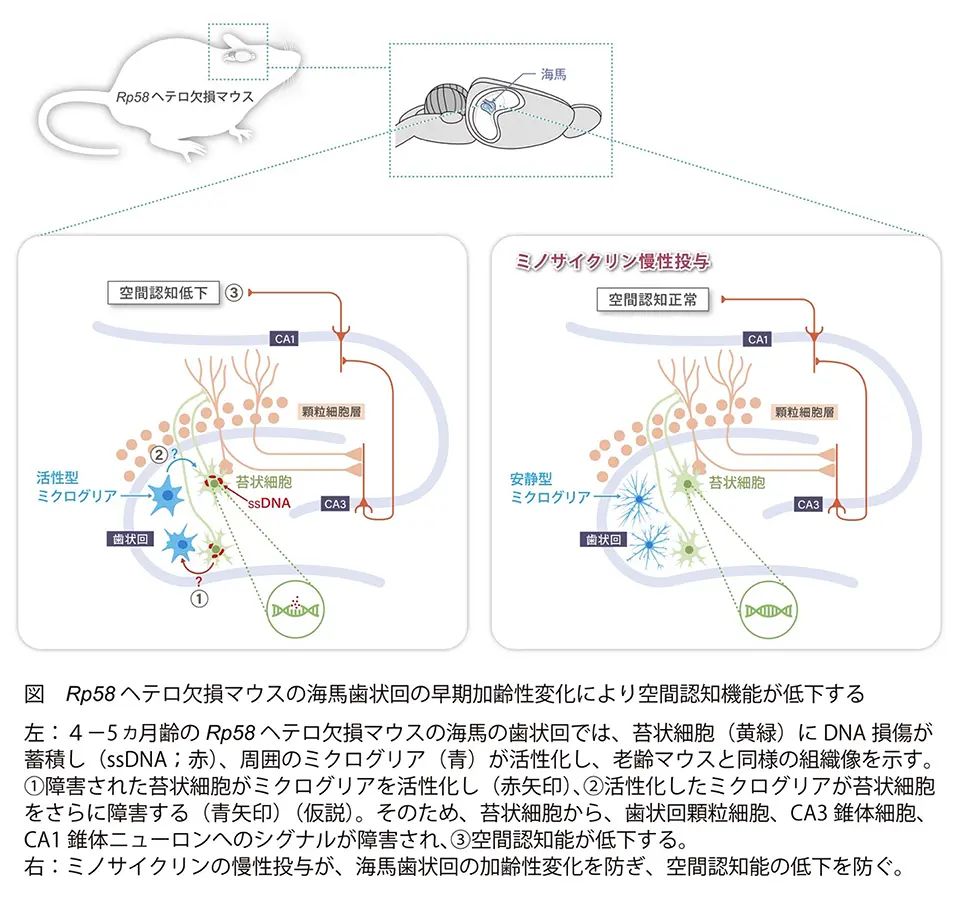
- 海馬歯状回の苔状細胞は、顆粒細胞から収束性の興奮を受け、両側性、広範性、発散性の興奮を返すことによって、空間記憶に重要な役割を果たしている。2ヵ月齢のRp58ヘテロ欠損マウスは、野生型マウス同様に、DNA損傷および蓄積マーカー陽性の苔状細胞はほとんど認められないが、4-5ヵ月齢においてDNA損傷、蓄積マーカ陽性苔状細胞の数は、野生型マウスに比べて有意に増加した(図)。このことは、Rp58ヘテロ欠損マウスは野生型と比較して、苔状細胞におけるDNA損傷蓄積が加速していることを示している。
- (3)Rp58ヘテロ欠損マウスの海馬において活性化ミクログリアの増加が認められる
- 活性化ミクログリアはDNA損傷を受けた神経細胞の周辺に集積することが知られているため、我々は次に海馬歯状回のミクログリアに注目した。Rp58ヘテロ欠損マウスでは、生後2ヵ月では野生型マウスと同程度の活性化ミクログリアの割合であったが、生後4-5ヵ月では野生型マウスと比較してCD68を指標にして評価した活性化ミクログリアの有意な増加が見られた(図)。
- (4)Rp58ヘテロ欠損マウスの海馬においてミトコンドリアの超微細構造が変化する
- 4-5ヵ月齢のRp58ヘテロ欠損マウスでは、海馬歯状回の神経細胞におけるミトコンドリアの大部分は形態的に加齢時に認められるタイプであることが電子顕微鏡解析で明らかとなった。
- (5)Rp58ヘテロ欠損マウスではDNA修復不全が検出された
- Rp58ヘテロ欠損マウスの放射線誘発DNA損傷からの回復を観察した結果、Rp58ヘテロ欠損マウスの海馬においてDNA損傷修復の遅延が認められた。このRp58ヘテロ欠損マウスにおけるDNA損傷修復の遅延は、DNA修復不全が原因である可能性が示唆された。
- (6)ミノサイクリンの慢性投与は早期老化の表現型を抑制する
- ミノサイクリンはテトラサイクリン系抗生物質であり、最近いくつかの神経変性疾患の進行に対して神経保護作用や抗炎症作用があることが示されている。ミノサイクリンの慢性投与は、4-5ヵ月齢のRp58ヘテロ欠損マウスの歯状回におけるDNA損傷蓄積苔状細胞の増加や活性化ミクログリアの増加を抑制し(図)、これに続く認知機能低下を予防した。
Rp58ヘテロ欠損マウスは、2ヵ月齢では野生型マウスと同程度の認知機能を持ちますが、4-5ヵ月齢では認知機能が低下することから、先天的な認知機能障害である知的障害だけでなく、後天的な認知機能障害である認知症を発症する可能性が示唆されます。認知症は知的障害患者の併存疾患であり、知的障害自体が認知症の危険因子と考えられます。高齢者の大脳皮質では、RP58の発現が著しく低下していることが報告されています。一方で、Rp58ヘテロ欠損マウスの早期認知機能低下はDNA修復障害と関連しており、ウェルナー症候群など多くの早期老化症候群はDNA修復関連遺伝子の変異によって引き起こされることが知られています。したがって、Rp58ヘテロ欠損マウスは、知的障害と認知症の関係を解析するモデル動物として有用と思われます。
社会的意義・今後の展望
この研究は、細胞がどのようにしてエピゲノム情報を維持、継承する過程における、複製フォーク保護複合体、特にMrc1/Claspinの役割とそのメカニズムを解明しました。このメカニズムは、ゲノム上のサイレンシング状態の維持に必須な役割をはたします。
社会的意義
RP58の発現量の不足が早期の加齢性空間認知機能低下を引き起こすことが実証され、その原因として、海馬におけるDNA修復不全によるDNA損傷蓄積、ミクログリアの活性化が示唆されました。この表現型は野生型マウスでは老年期に見られるものです。したがって、RP58の発現量の不足が、海馬の加齢性変化を加速し、空間認知機能低下を惹起したと推察されます。RP58がDNA損傷修復を制御するメカニズムを解明するためには、さらなる研究が必要です。
本研究ではミノサイクリンの投与により、上記症状を改善させることに成功しました。RP58は加齢により発現が減少することが報告されており、加齢性の認知機能低下はRP58の加齢に伴う発現減少が原因かもしれません。したがって、ミノサイクリン投与がRP58ハプロ不全の認知機能低下を予防することに加えて、今後、非疾患群の加齢性認知機能低下の予防にもつながることが期待されます。
<用語解説>
- (注1)ZBTB18/ RP58ハプロ不全
- ハプロ不全(haploinsufficiency)とは、正常な単一アリルのみからの遺伝子発現量では効果が不足し、正常な機能を維持することができないことによる疾患。 ZBTB18/ RP58の正常な遺伝子産物(タンパク質やRNA)の量的不足に起因し、遺伝形式は顕性遺伝(優性遺伝)となる。多くは遺伝ではなく、親の生殖細胞や受精後に新たに発生した個体レベルで生じる突然変異(de novo変異)による。
- (注2)苔状細胞
- 苔状細胞(mossy cells)は海馬歯状回門に存在する樹状突起に「苔状」の構造がある大型のグルタミン酸作動性神経細胞でRP58を豊富に発現している。歯状回顆粒細胞から入力を受け、顆粒細胞に出力し、空間認知に重要である(図)。苔状細胞は脆弱であり、神経疾患や精神疾患の病態において重要な役割を果たしている可能性がある。
- (注3)1q43q44微小欠失症候群
- サブテロメア微細欠失症候群の一つである。脳梁異常、筋緊張低下、小頭症、成長障害及び多様な顔面異形を頻繁に併発する知的発達障害を特徴とする。常染色体顕性(優性)知的発達障害22 (MRD22) であり、1q43q44 領域のZBTB18(別名RP58, ZNF238)遺伝子、AKTセリン/スレオニンキナーゼ3(AKT3)遺伝子、ヘテロ核リボヌクレオタンパク質U (HNRNPU)遺伝子、CEP170遺伝子等のハプロ不全が原因と考えられる。
- (注4)海馬CA1領域(図)のシータパワー
- 海馬CA1領域(図)のシータパワーは、海馬の神経活動における特定のリズミックな振動を指す。シータ波は、典型的には4〜8 Hzの周波数帯域で発生し、特に空間的なナビゲーション、記憶形成、注意力の制御など、認知機能において重要な役割を果たす。海馬CA1領域でのシータパワーの増加は、学習や記憶のプロセスに関連し、例えば、動物が新しい環境を探索する際に、顕著に増加することが知られている。
文献
- (文献1)
- Okado H (2021) Nervous system regulated by POZ domain Krüppel-like zinc finger (POK) family transcription repressor RP58. Br J Pharmacol. 178:813-826.
- (文献2)
- Hirai S, Miwa H, Shimbo H, Nakajima K, Kondo M, Tanaka T, Ohtaka-Maruyama C, Hirai S, Okado H. (2023) The mouse model of intellectual disability by ZBTB18/RP58 haploinsufficiency shows cognitive dysfunction with synaptic impairment. Mol Psychiatry. 2023 Jun;28(6):2370-2381.
RP58変異マウスの使用に関して葛西正孝博士に感謝します。また、齊藤実博士、倉林信博博士、橋本款博士、三輪秀樹博士、塩谷和基博士、谷隅勇太博士の貴重な助言に感謝します。
<本研究の主な助成事業>
日本学術振興会科研費(18H02537、 22H02729、23K18169(以上岡戸)、17K16408(田中)、21H05130、21K18231(以上吉種))、 AMED-PRIMEプログラム(20gm6110010h0004)AMED-FORCEプログラム(22gm4010019h0001)、JST-FORESTプログラム(JPMJFR2150)(以上吉種)、武田科学振興財団(平井)、パブリックヘルス科学研究助成金、内藤記念科学振興財団 女性研究者研究助成金および公益財団法人鈴木謙三記念医科学応用研究財団(以上田中)の支援を受けました。
