2024年10月8日
体内時計プロジェクトの倉林伸博主席研究員、吉種光プロジェクトリーダーらは、「タンパク質量の24時間リズムに関与する分解制御因子を発見」について Communications Biology に発表しました。
タンパク質量の24時間リズムに関与する分解制御因子を発見
当研究所・体内時計プロジェクトの倉林伸博主席研究員、吉種光プロジェクトリーダー(東京大学 大学院理学系研究科 生物科学専攻 准教授兼任)、東京大学 大学院理学系研究科 生物科学専攻 増田周作 大学院生(研究当時)、東京大学 大学院理学系研究科 生物科学専攻深田吉孝教授(現、東京大学名誉教授)らは、タンパク質量の24時間リズムに関与する分解制御因子を発見しました。概日時計は、食事や睡眠といった一日の中のさまざまな活動に合わせて生理機能を制御し、各機能に関与する生体分子の量を時刻に応じて変動させます。本研究では、生理機能の概日リズムに重要な時計タンパク質DBPが、2つのE2酵素とE3リガーゼTRAF7により分解されていることを明らかにしました。本研究成果は、タンパク質が特定の時刻に向かって蓄積した後、どのような分解制御によって減少するのかについて示唆を与えるものであり、概日時計によるタイムリーな制御を支えるメカニズムの理解に重要な成果といえます。
この研究成果は2024年10月8日(火)(日本時間)に米国科学誌「Communications Biology」のオンライン版に掲載されました。
- <論文タイトル>
- “TRAF7 determines circadian period through ubiquitination and degradation of DBP”
(TRAF7はDBPのユビキチン化および分解を介して概日周期を決定する) - <発表雑誌>
- Communications Biology
DOI: 10.1038/s42003-024-07002-x
URL:https://doi.org/10.1038/s42003-024-07002-x
研究の背景
概日時計は、食事や睡眠といった一日の中のさまざまな活動に合わせて生理機能を制御し、各機能に関与する生体分子の量を時刻に応じて変動させます。哺乳類の遺伝子の43%は一日の中で発現量が変化しており、各生理機能はこれらの遺伝子、ないしこれらをもとに生成するタンパク質により制御されます。
DBPタンパク質はマウス肝臓において夕方に蓄積し、明け方には検出できないほど減少する顕著な概日リズムを示すことが知られています。また、DBPは特定のDNA配列に結合し、その制御下の遺伝子の発現を促進する機能を有する転写因子*1 であるため、DBPタンパク質の時刻依存的な増減のサイクルが、その下流の遺伝子の増減サイクルに伝播すると考えられます。代表的なものとして、薬物代謝、遊離脂肪酸代謝、血圧の日内変動が、DBPタンパク質の制御下にあることが報告されています。
DBPタンパク質量の概日リズムに関しては、これまで合成、すなわち発現制御に関する報告が主でした。すなわち、概日時計の中心的な転写因子であるCLOCK及びBMAL1の複合体により、一日の特定の時間帯にDbp遺伝子の転写が活性化するというものです。一方で、合成されたDBPタンパク質がどのような制御を受けて分解するかについて明らかにされておらず、分解に関与する具体的なタンパク質は特定されていませんでした。
私たちは質量分析などの手法を用いてDBPタンパク質の分解に関与するE3リガーゼTRAF7を同定しました。
研究の内容
東京大学 大学院理学系研究科 生物科学専攻 増田周作 大学院生(研究当時)、当研究所 体内時計プロジェクト 倉林伸博主席研究員、吉種光プロジェクトリーダー(東京大学 大学院理学系研究科 生物科学専攻 准教授兼任)、東京大学 大学院理学系研究科 生物科学専攻深田吉孝教授(現、東京大学名誉教授)らは、DBPタンパク質の分解制御に関与する因子を探索しました。
タンパク質の分解系として、主にリソソームによる分解と、ユビキチンプロテアソーム系による分解が挙げられます。ユビキチンプロテアソーム系とは、ユビキチンという76アミノ酸からなる小分子により標識(ユビキチン化)されたタンパク質をプロテアソームという分解酵素複合体が認識し、分解する仕組みです。ユビキチンはユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)と呼ばれる3つの酵素の働きにより、標的タンパク質のリジン残基に結合します。また、ユビキチン自体にもリジン残基が存在し、このリジン残基にさらにユビキチンが結合することで、ユビキチン鎖が形成されます。
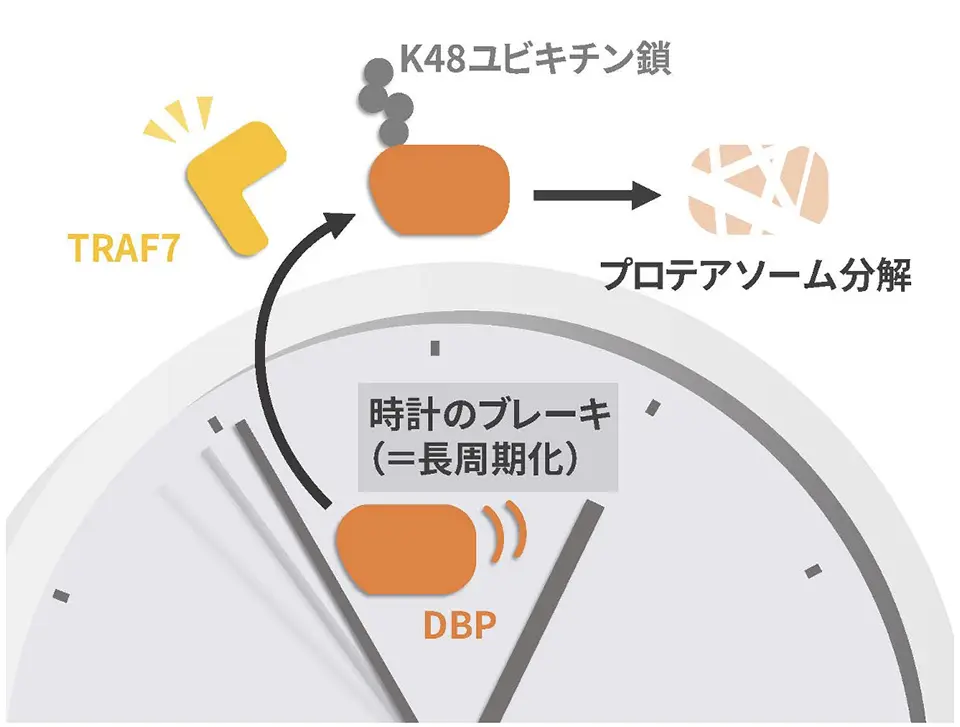
リソソームやプロテアソームの阻害剤を用いた実験から、DBPタンパク質の分解は主にユビキチンプロテアソーム系により担われることがわかりました。また、この分解には2つのユビキチン結合酵素UBE2G1、UBE2Tと1つのユビキチンリガーゼTRAF7が関わることがわかりました。
次に、TRAF7を欠損させた培養細胞を作製したところ、この細胞において、DBPの最大量が約2倍に増加したことから、TRAF7によるDBPの分解は、特に発現量の最大値を調節する役割を担うと考えられました。
生体におけるTRAF7の機能をさらに調べるために、TRAF7を欠損させたマウスを作製したところ、予想に反して、その肝臓内においてDBPタンパク質量は野生型マウスと大きく変わりませんでした。一方でDBPの制御下にある複数のタンパク質の発現パターンが変化していたことから、TRAF7が存在しないことで、DBPの転写活性が変化した可能性が考えられました。
培養細胞を用いてDBPの転写活性を検証したところ、TRAF7を同時に発現させたときにはDBPの転写活性が低下したことから、TRAF7には、DBPの分解を制御するという機能に加えて、DBPの活性を制御する機能を有する可能性が考えられました。
最後に、TRAF7による概日時計のリズム性への影響を調べました。DBPを過剰発現すると概日時計の周期は長くなり、ノックダウンすると短くなることが知られています。TRAF7を過剰発現してDBPの量を減少させたところ、概日時計の周期が短くなり、上記の知見と合致する結果が得られました。また、DBPを過剰発現して、Bmal1_lucレポーターにより概日時計の振動を発光の変化として検出すると、その発光リズムの振幅が減少することが知られています。この実験系において、DBPに加えてTRAF7を過剰発現させたところ、振幅が回復したことから、TRAF7は、DBPのユビキチン化を介して概日時計の振動を調整している可能性が考えられました。
以上のように、私たちはDBPタンパク質の分解に関わる分子として、UBE2G1、UBE2TおよびTRAF7を同定しました。また、TRAF7はDBPタンパク質の分解だけではなく、ユビキチン化によりDBPタンパク質の転写活性を制御し、ひいては概日時計の周期を調節していることを報告しました。
社会的意義・今後の展望
概日時計はDBPなどの転写因子を介してさまざまな生理機能を調整し、一日の特定の時間帯に適合するよう体の状態を整えています。海外旅行などによる時差ボケにより体調が悪くなるのは概日時計による制御が乱れるためと考えられています。今回の研究によりDBPタンパク質の量や活性を制御する分子が特定されたことで、概日時計による制御の乱れを回復させる新たな戦略につながる可能性が考えられます。
用語解説
- *1: 転写因子・転写制御
- 生物を形作る設計図はゲノムとよばれるDNA分子上に書き込まれています。そこにある遺伝子とよばれる配列をもとにタンパク質という製品が生産され、さまざまな生体の機能が形作られています。このとき、DNA上の遺伝子$配列がmRNAというより短い分子に写し取られ(転写)、この短いRNAが読み取り装置(リボソーム)にかけられると遺伝子ごとのタンパク質がつくられます。遺伝子をコードするゲノムは細胞につき一対しかなく、ほとんどの細胞では同一です。一方、1つのゲノムDNAから多様なRNAが大量に転写されます。よって、生物はおかれた環境や細胞ごとに適切なタンパク質を適切な量作るために、状況に応じてRNAへの転写量を遺伝子ごとに調節しています。この調節を行うタンパク質の一群が転写因子と呼ばれます。
