2024年5月28日
体内時計プロジェクトの乙部優太研究員、吉種光プロジェクトリーダーらは、「体内時計の正確なカウントに重要なリン酸化修飾部位を発見」について PNAS に発表しました。
体内時計の正確なカウントに重要なリン酸化修飾部位を発見
体内時計プロジェクトの乙部優太研究員(研究当時 東京大学 大学院理学系研究科 生物科学専攻 大学院生)と吉種光プロジェクトリーダー(同専攻 准教授兼任)らは、ほ乳類の概日時計の周期長を決定しているリン酸化修飾部位を発見しました。概日時計は睡眠・覚醒など毎日24時間周期で繰り返す生理機能リズムを生み出します。概日時計の乱れは高血圧や糖尿病、心臓疾患など、さまざまな疾患の原因となります。本研究では、培養細胞を用いたノックアウトレスキュー実験系と数理モデルを用いたシミュレーション (韓国KAISTとの共同研究)を組み合わせることで、概日時計の中心因子であるCLOCKとBMAL1タンパク質の、周期決定に重要なリン酸化修飾部位の同定と、その分子メカニズムを明らかにしました。本研究成果は、生物が細胞レベルで一日を正確にカウントする仕組みの理解に繋がり、将来、体内時計を自在に操作することが可能になると期待されます。
この研究成果は2024年5月28日(火)に米国科学誌「Proceedings of the National Academy of Sciences (PNAS)」のオンライン版に掲載されました。
- <論文タイトル>
- “Phosphorylation of DNA-binding domains of CLOCK-BMAL1 complex for PER-dependent inhibition in circadian clock of mammalian cells.”
(CLOCK-BMAL1複合体のDNA結合部位へのリン酸化はマウス概日時計におけるPER依存的転写抑制を制御する) - <発表雑誌>
- Proceedings of the National Academy of Sciences (PNAS)
DOI:10.1073/pnas.2316858121.
URL:https://www.pnas.org/doi/10.1073/pnas.2316858121
研究の背景
生物には自身の生命を保つためのさまざまな機能が存在しますが、それぞれの機能が十分に発揮されるためには個々の分子、細胞、組織がタイミングよく協調して働く必要があります。そのために、生体にはさまざまな時間を計るタイマー(体内時計)が存在します。例えば我々ヒトは、明るい昼に全身の代謝が高められ活動的になりますが、暗い夜には睡眠などによって全身でエネルギーを蓄えるようになっており、これは約24時間周期で振動する「概日時計」と呼ばれるタイマーが数多くの遺伝子や生体の機能を協調して制御することで可能になります。このような24時間のタイマーは生物個体レベルのみならず、組織レベル、単一培養細胞レベルで存在することがわかっており、その分子メカニズムは一群の時計タンパク質による転写制御(*1)によると考えられています。
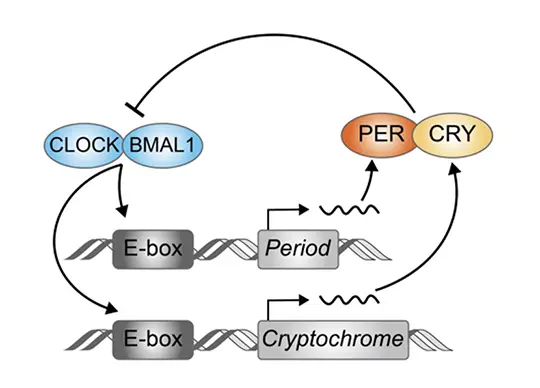
例えば哺乳類において、CLOCKとBMAL1という転写因子(*1)の働きが高まると、その標的となる多くの遺伝子の転写が促進されます。そのうちの一つにPerという遺伝子があり、これにはCLOCKとBMAL1の働きを抑える作用があります。この負のフィードバック作用によって、CLOCKとBMAL1の働きの強さは一日周期で変化します(図1)。具体的には、CLOCKとBMAL1の活性が朝方に高くなると、多くの遺伝子とともにPerが転写されます。PERタンパク質がCLOCK-BMAL1の活性を抑えるので、夜にはCLOCK-BMAL1の活性は低くなります。CLOCK-BMAL1の活性が低くなると、PERの量が減ることになるので、また朝にかけてCLOCK-BMAL1の活性が高くなるというわけです。つまり精巧で安定な24時間を刻むタイマーを刻み続けるためには、各ステップのスピードが重要です。
特に重要なPERタンパク質によるCLOCK-BMAL1の抑制ステップはこれまで、PERによって連れてこられる転写抑制因子によるCLOCK-BMAL1近傍のクロマチン状態の変化によると考えられてきました。しかし近年、PERによって連れてこられるCK1キナーゼがCLOCKをリン酸化修飾(*2)することによってCLOCK-BMAL1をDNAから引き離すという仕組みが存在することが報告されました。しかしこの新しい転写抑制メカニズムの概日時計における重要性はわかっていませんでした。
我々はこれまでに、CLOCKとBMAL1は時刻依存的にリン酸化修飾されることを明らかにしています。リン酸化もDNAも負電荷を持つために静電気的反発によって、リン酸化されたCLOCKやBMAL1はDNAとの結合が弱くなることが考えられます。そこでPERによる新しい抑制メカニズムを担う、CLOCKやBMAL1のリン酸化修飾部位をアミノ酸残基レベルで同定することに取り組みました。
研究の内容
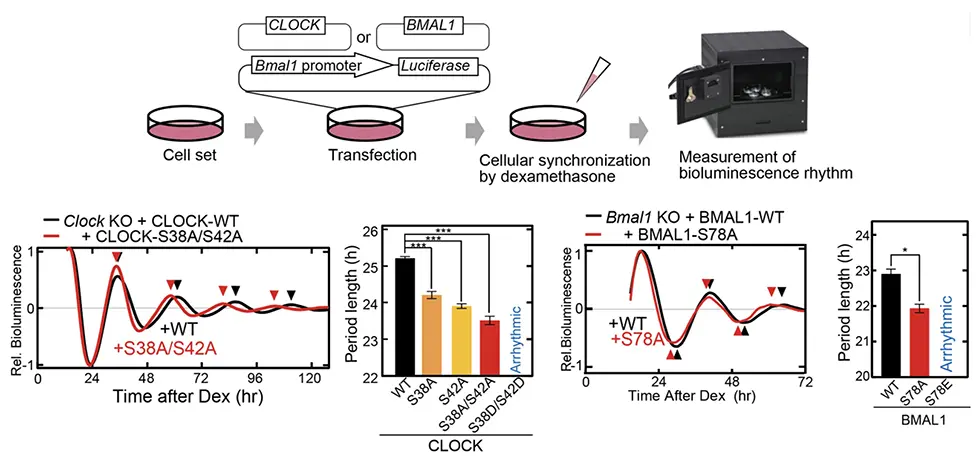
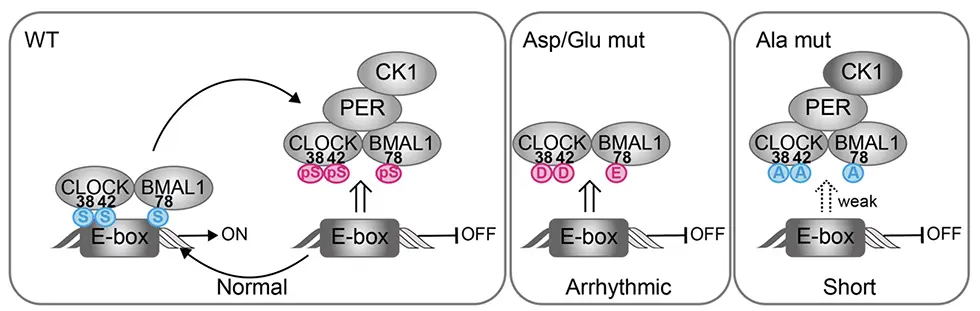
体内時計プロジェクトの乙部優太研究員(研究当時 東京大学大学院理学系研究科 生物科学専攻 大学院生)と、伊藤舜喬氏(研究当時 同専攻 大学院生)、深田吉孝 東京大学名誉教授、吉種光プロジェクトリーダー(同専攻 准教授兼任)らの研究グループは、韓国KAISTのKim博士、Jeong博士らとの国際共同研究として、培養細胞を用いたノックアウトレスキュー実験系と数理モデルを組み合わせてこの問題に取り組みました。ノックアウトレスキューを用いたスクリーニングの結果、CLOCKやBMAL1のDNA結合部位に位置するセリン残基 (CLOCK-S38A/S42A や BMAL1-S78A) をアラニンに置換(非リン酸化模倣)すると概日リズムが短縮することがわかりました (図2)。さらに興味深いことに、これら部位をアスパラギン酸やグルタミン酸に置換(恒常的リン酸化模倣)すると概日リズムが消失することがわかりました。これらの結果は、CLOCKとBMAL1のDNA結合ドメイン内のこれらセリン残基が、概日時計の周期決定において重要なアミノ酸残基であることを示しています。おそらく、これらリン酸化修飾がDNA認識部位へ負電荷を与えることで、CLOCK-BMAL1のE-boxからの解離タイミングが制御され、概日時計の周期が決定されると考えています。
この仮説を検証するために、時計数理モデル(*3)を用いて変異体における体内時計フィードバック制御をシミュレートしました。CLOCKやBMAL1の恒常的リン酸化状態を模倣するために、CLOCK-BMAL1のDNA結合を常時弱くすると概日リズムが消失し、実験と同様の結果になりました。次に、CLOCKやBMAL1の非リン酸化状態では、リン酸化修飾依存的なCLOCK-BMAL1複合体のDNAからの解離が抑制されるため、DNA結合が強くなると想定されます。そこでCLOCKやBMAL1のDNA結合を常時強くすると長周期になり、実験と異なる結果になりました。そこで特定の状態のCLOCK-BMAL1複合体に対して非リン酸化体が作用すると考えてシミュレーションを行うと、CLOCK-BMAL1-PER複合体においてDNA結合を強くすると短周期になり、実験と同様の結果になりました。PERはCLOCK-BMAL1複合体をDNAから解離させることによって転写を抑制するため、この抑制メカニズムの減弱は概日リズムを短縮させることがわかりました。さらに生化学的実験によって、3つのセリン残基がPER依存的な転写抑制に関わることを見出しました。
まとめると、分子生物学的実験と数理シミュレーションを組み合わせることで、CLOCK-Ser38/Ser42とBMAL1-Ser78のリン酸化修飾がPER依存的な転写抑制の一端を担うことが明らかとなりました (図3)。さらにこれらの機能的リン酸化はPER依存的な転写抑制フェーズにピークをもったリズムを示すことが示唆され、時刻依存的なリン酸化により正確で安定な時計振動が駆動されることがわかりました。
社会的意義・今後の展望
先に述べた通り、概日リズムは我々自身の生体機能、すなわち健康と直結します。特に概日リズムの周期の変化は朝型や夜型などの「クロノタイプ」の原因となることが知られています。本研究によって明らかとなったリン酸化の状態を自在に操ることができるようになれば、社会活動が困難な程のクロノタイプや、海外旅行やシフトワークによる “時差ボケ”の改善につながると期待されます。

リン酸化制御(Pと表現)が体内時計の周期を制御する。
<用語解説>
- (*1 転写制御・転写因子)
- 生物を形作る設計図はゲノムとよばれるDNA分子上に書き込まれています。そこにある遺伝子とよばれる配列をもとにタンパク質という製品が生産され、さまざまな生体の機能が形作られています。このとき、DNA上の遺伝子配列がmRNAというより短い分子に写し取られ(転写)、この短いRNAが読み取り装置(リボソーム)にかけられると遺伝子ごとのタンパク質がつくられます。遺伝子をコードするゲノムは細胞につき一対しかなく、ほとんどの細胞では同一です。一方、1つのゲノムDNAから多様なRNAが大量に転写されます。よって、生物はおかれた環境や細胞ごとに適切なタンパク質を適切な量作るために、状況に応じてRNAへの転写量を遺伝子ごとに調節しています。この調節を行うタンパク質の一群が転写因子と呼ばれます。
- (*2 リン酸化修飾)
- タンパク質に付加する翻訳後修飾の一種。リン酸化修飾はタンパク質の立体構造や相互作用を変化させることで、シグナル伝達の制御やアポトーシス、代謝、増殖等の多くの生理学的プロセスに影響を与える。CK1などのプロテインキナーゼは、基質となるタンパク質のセリンやスレオニン、チロシンのアミノ酸残基とリン酸の共有結合を触媒する。
- (*3 時計数理モデル)
- 体内時計の振動を数理的に再現したモデル。概日時計に関与するDNA配列(E-boxなど)を介した遺伝子の転写や翻訳、翻訳後修飾などの制御を、多くの変数およびパラメーターを用いて数式に表すことで、体内時計のシミュレーションを可能にしている。
