2024年8月8日
蛋白質代謝研究室の吉田雪子室長・田中啓二理事長らは、「糖タンパク質の新規ユビキチン化機構の発見〜糖を介した転写因子のユビキチン化〜」について Molecular Cell に発表しました。
糖タンパク質の新規ユビキチン化機構の発見
〜糖を介した転写因子のユビキチン化〜
当研究所 蛋白質代謝研究室の吉田雪子室長・故田中啓二理事長(令和6年7月23日逝去)・遠藤彬則主席研究員、土屋光客員研究員(現・順天堂大学)、佐伯泰客員研究員(現・東京大学)らは、群馬大学大学院理工学府分子科学部門の高橋剛准教授・松尾一郎教授、理化学研究所の堂前直ユニットリーダー・鈴木匡主任研究員らと共同で、さまざまな生命現象や疾患に関わる分子「ユビキチン」による糖タンパク質の新たな修飾機構を発見しました。この発見は、病態生理学や基礎生物学など広範囲な波及効果が期待されます。
この研究成果は2024年8月8日(木)午前0時(日本時間)に米国科学誌「Molecular Cell」のオンライン版に掲載されました。
- <論文タイトル>
- “Sugar-mediated non-canonical ubiquitination impairs Nrf1/NFE2L1 activation”
(糖を介した非典型ユビキチン化はNrf1/NFE2L1の活性化を阻害する) - <発表雑誌>
- Molecular Cell
DOI: 10.1016/j.molcel.2024.07.013
URL:https://doi.org/10.1016/j.molcel.2024.07.013
発表のポイント
- 生命の維持に必須なタンパク質分解装置プロテアソーム(注1)の発現調節を行う糖タンパク質Nrf1(注2)が、極めて珍しいユビキチン化を受けることを発見しました。
- ユビキチンは通常タンパク質のリジン(注3)の側鎖に結合しますが、この反応ではタンパク質に結合した糖鎖近傍のセリン(注3)やスレオニン(注3)(アミノ酸)・N-アセチルグルコサミン(糖)などのヒドロキシ基に結合し、合成されたユビキチン鎖(注4)は複雑に分岐し、細胞中で安定に保たれます。
- このユビキチン化は糖鎖除去酵素(ENGASE)(注5)によりタンパク質表面にN-アセチルグルコサミンが生じる反応をきっかけとして起こり、複数のユビキチンリガーゼを必要とする新規の反応機構でした。
- このユビキチン化はプロテアソームの発現に必要な転写因子であるNrf1を不活性化するものであり、プロテアソーム機能の低下を伴う希少遺伝疾患NGLY1欠損症(注6)の発症の原因と考えられます。
社会的意義
プロテアソームの調節異常は、加齢に伴う神経変性疾患のほとんどに関与しており、変性タンパク質の蓄積の増大が、加齢に伴う細胞や生体の機能低下を引き起こす原因となっている可能性があります。今回報告したユビキチンリガーゼFBS2-ARIH1による異常なユビキチン化は、プロテアソームの機能障害時に活性を回復させるNrf1を正常に働かなくする機構であり、NGLY1欠損症の治療標的としてのみならず、プロテアソームの機能障害に関連する疾患の治療に対する新たな戦略につながる可能性も考えられます。
研究の背景
2004 年に、真核細胞における選択的タンパク質分解系「ユビキチン・プロテアソームシステムの発見」にノーベル化学賞が与えられています。プロテアソームは、細胞内のほとんどのタンパク質の寿命を制御し、損傷タンパク質や正しい立体構造をとれなかった異常タンパク質の分解を担うタンパク質分解酵素複合体です。異常タンパク質の蓄積は、老化や神経変性疾患の一般的な特徴であり、プロテアソームの調節異常は、加齢に伴う神経変性疾患に関与していることから、プロテアソーム活性が正常に保たれることは、私たちの健康に極めて大切です。プロテアソームに分解されるタンパク質にはユビキチンが目印として付けられます。
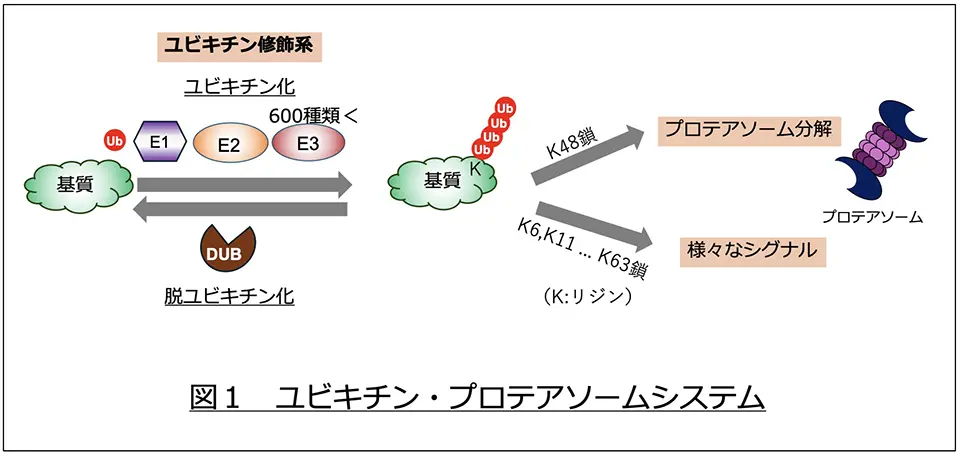
ユビキチンは76アミノ酸よりなる小さなタンパク質で、ユビキチン活性化酵素(E1・2種類)、ユビキチン結合酵素(E2・40種類)、ユビキチンリガーゼ(E3・600種類以上)の3種類の酵素の組み合わせによって、通常特定のタンパク質(基質)のリジンに結合します。多くの場合、この反応が繰り返されて鎖状のユビキチン鎖を形成します(図1)。ユビキチン鎖の結合様式により、プロテアソームによる分解以外にも、外来分子の細胞内への取り込み・シグナル伝達・免疫反応などさまざまな生命現象のシグナルとして機能します。また、このユビキチン化は他の修飾と同様に可逆的な反応であり、脱ユビキチン化酵素によって外されます。
NGLY1はタンパク質に結合した糖鎖を根元から切断する酵素で、変性した糖タンパク質の分解に関与していますが、その遺伝子に変異をもつ人は遺伝性の希少疾患NGLY1欠損症を発症します。その動物モデルとして作出されたNGLY1-KOマウスは胚性致死ですが、私たちは糖鎖を認識するユビキチンリガーゼFBS2の同時欠損でその致死性を回避できることを見出してきました。このことはNGLY1が正常に働かない状態で、糖鎖を認識するユビキチン化が起きると細胞が異常となることを示唆しています。
私たちは恒常性の維持に重要なプロテアソームの発現を制御するNrf1という転写因子が、遺伝性希少疾患NGLY1欠損症の細胞中で、特別なユビキチン化を受け、それがNrf1の不活性化の原因となっていることに着目し研究を行いました。
研究の内容
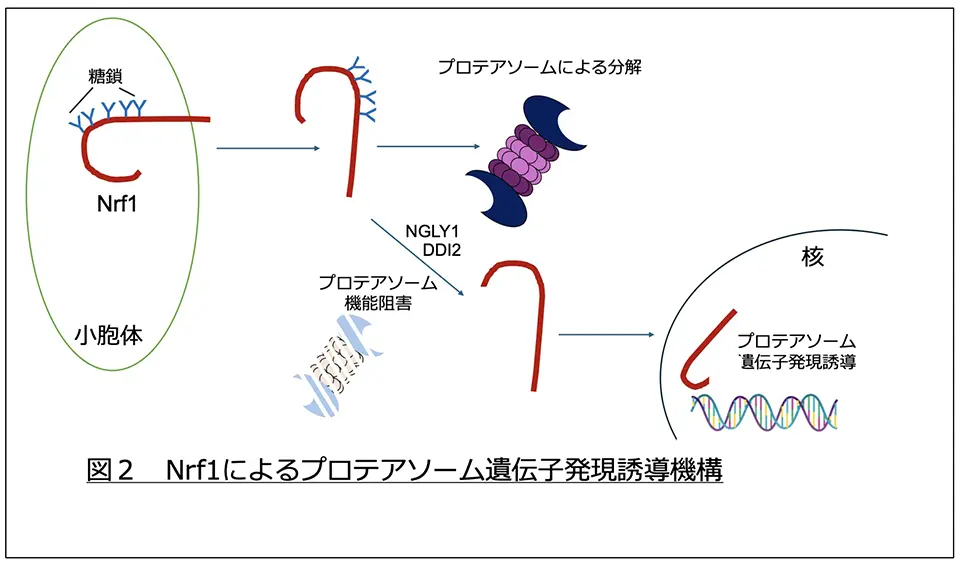
Nrf1は細胞で生合成されるとすぐにプロテアソームにより分解されるため、細胞中にはほとんど存在しないタンパク質です。一方で、プロテアソーム活性が低下した時には分解を免れ、核に輸送されプロテアソーム遺伝子の発現を誘導し、新たなプロテアソームが作り出されます(図2)。Nrf1は糖タンパク質であり、最近の研究でNGLY1による糖鎖脱離がNrf1の活性化、ひいてはプロテアソームの発現増加に必要であるということがわかってきていました。私達はこれまでの研究でNGLY1活性のない状態では、糖鎖を認識するユビキチンリガーゼにより高度にユビキチンを受けたNrf1が細胞の中に安定に存在するという現象を見出していました。通常はユビキチン化を受けたタンパク質はプロテアソームにより分解を受けるため、ユビキチン化タンパク質が安定に存在するというのは大変不思議な現象です。
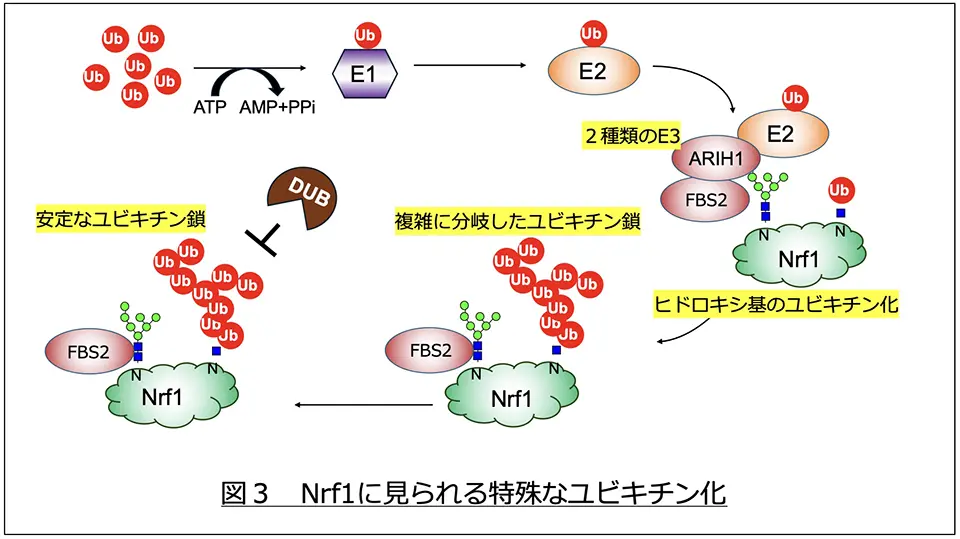
今回の研究では、その異常なユビキチン化が、通常のユビキチン修飾部位であるリジンをすべて別のアミノ酸に置換しても生じること、NGLY1とは別の脱糖鎖酵素ENGASEの活性がこのユビキチン化に必要であることを新たに見出しました。そこで、Nrf1ではENGASEにより生じるN-アセチルグルコサミン(GlcNAc)という糖にユビキチンがつくのではないかと仮説を立てて検証実験を行いました。
合成した糖鎖や糖の誘導体を付加したさまざまな糖ペプチドを用いてユビキチン化を試験管内で再構成する系を作出して検証を行った結果、このユビキチン化は糖鎖がつく近傍のセリンやスレオニンのアミノ酸とENGASEの働きにより生じるGlcNAcの水酸基に結合することを見出しました。また、この反応には糖鎖認識ユビキチンリガーゼFBS2と共にもうひとつのユビキチンリガーゼARIH1が必要であることや、形成されるユビキチン鎖がこれまで例を見ないような複雑に分岐した形態をとることも明らかとなりました。また、この異常なユビキチン鎖は通常とは異なり、脱ユビキチン化酵素が働きにくい特徴をもつため、Nrf1はNGLY1がない状態では細胞内で安定にユビキチン化タンパク質として検出されるものと考えられました(図3)。
これまで、ユビキチン化はタンパク質に起こる反応とされてきましたが、最近ではタンパク質以外に脂質やオリゴ糖のユビキチン化なども、発見され始めています。今回の研究では、糖タンパク質の糖鎖が外される過程で生じる糖がユビキチン化され得ることを示しました。
用語解説
- (注1)プロテアソーム:
- 真核生物に存在する分子量250万、およそ100個のサブユニットからなる巨大タンパク質分解装置。エネルギー依存的にユビキチン化タンパク質を分解します。当研究所の田中啓二理事長とハーバード大のアルフレッド・ゴールドバーグ博士が発見。
- (注2)Nrf1(エヌアールエフワン):
- 小胞体の膜結合型糖タンパク質。プロテアソームの活性が低下すると、NGLY1(エヌグリワン)により糖鎖が外され、DDI2という酵素にN末部分を切り取られることで活性化し、核へ移動し、プロテアソームの合成を誘導する転写因子として働くようになります。
- (注3)リジン:
- タンパク質は20種類のアミノ酸からなっていますが、さまざまなタンパク質の修飾機構があり、それぞれ特定のアミノ酸の側鎖が修飾されることが知られています。最も多いリン酸化はセリン・スレオニン・チロシンなどに、糖鎖修飾はアスパラギン(N型)、セリン・スレオニン(O型)、そしてユビキチン化はリジンの修飾がよく知られています。
- (注4)ユビキチン鎖:
- ユビキチンの7箇所あるリジンとN末のメチオニンを介した8種類のユビキチン鎖があります。最近では2〜3種類の結合様式が組み合わさった混合鎖なども報告されてきています。
- (注5)ENGASE(エンゲース):
- NGLY1と同様に細胞質にある脱糖鎖酵素。NGLY1がN型糖鎖の根元から糖鎖を除去するのに対し、ENGASEはGlcNAc1糖を残して除去します。
- (注6)NGLY1欠損症:
- 糖鎖は小胞体と呼ばれる細胞小器官で付加されるため、通常は細胞小器官や細胞外にしか存在しませんが、糖鎖除去酵素NGLY1は通常は糖鎖のない細胞質に存在し、主に細胞質に放出されるフォールディング不全の糖タンパク質の分解に関与しています。NGLY1遺伝子に変異を持ちNGLY1活性を失った希少疾患NGLY1欠損症が報告され、その機能解析が進んできています。この疾患はまだ世界で100例強しか報告されていない疾患で、全身性の重篤なものです。
本研究の主な助成事業
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「プロテオスタシスの理解と革新的医療の創出」研究開発領域における研究開発課題「細胞質における糖鎖生物学―細胞恒常性維持の包括的理解を目指して」(研究開発代表者:鈴木匡JP22/23gm14100003h0003/4)、科学研究費補助金(JP22H02305;23H00375;JP22H00419)、JST-CREST(JPMJCR16H3)、群馬大学重点支援プロジェクトなどの支援を受けて行われました。
