2024年6月13日
脳神経回路形成プロジェクトの金子乃愛(元研修生)、丸山千秋プロジェクトリーダーらは、「発生期大脳皮質で移動ニューロンはADAMTS2プロテアーゼを分泌して神経細胞移動を制御する」について EMBO reports に発表しました。
発生期大脳皮質で移動ニューロンはADAMTS2プロテアーゼを分泌して神経細胞移動を制御する
~サブプレート層の細胞外基質の役割を解明した論文が掲載~
当研究所脳神経回路形成プロジェクトの金子乃愛(元研修生)、丸山千秋プロジェクトリーダーらは、細胞外で働くメタロプロテアーゼADAMTS2が発生期大脳皮質の神経細胞移動に重要な機能を果たしていることを明らかにしました。
成果は国際科学雑誌『EMBOreports』に2024年6月13日にオンライン掲載されました。
哺乳類の大脳新皮質は6層構造を取りますが、サブプレート(SP)層はその最深部に位置するニューロン層です。SP層にはサブプレートニューロンの他に、コラーゲン、フィブロネクチンやプロテオグリカン等の細胞外基質(ECM)が豊富に存在することはわかっていましたが、その役割や重要性は不明でした。今回我々は新生移動ニューロンがメタロプロテアーゼであるADAMTS2を分泌してSP層直下にてバーシカンやLTBP1等のECMを分解することでTGF-βを活性化することで移動モードの変換を促すことを発見しました。
- <論文タイトル>
- “ADAMTS2 promotes radial migration by activating TGF-β signaling in the developing neocortex”
(ADAMTS2は発生期大脳皮質でTGF-βシグナルを活性化することで放射状神経細胞移動を促進する) - <発表雑誌>
- EMBO reports 2024, Jun 13.
DOI:10.1038/s44319-024-00174-x.
研究の背景
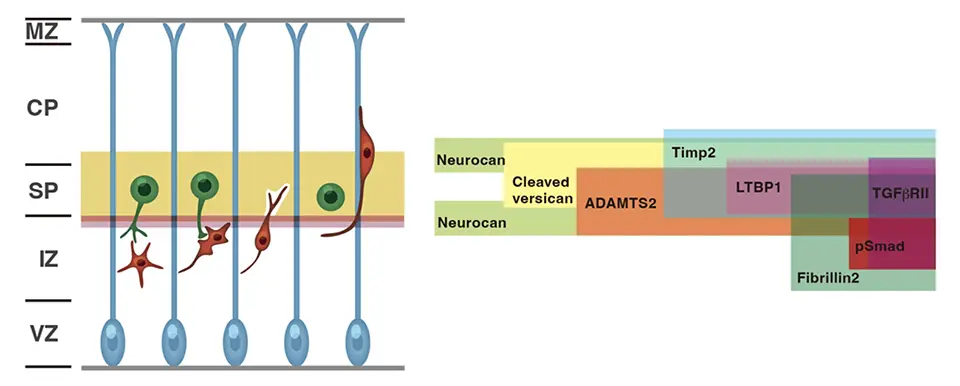
サブプレート(SP)層は大脳皮質で最初期に生まれるサブプレートニューロン(SpN)と豊富な細胞外基質からなる、哺乳類独特のニューロン層です。SpNは神経細胞移動のモード変換を促進するほか、視床から皮質への投射を制御する役割も担っていますが、SP層になぜ豊富なECMが存在するのか、その役割や重要性は不明でした(図1)。ECMはコラーゲンやヒアルロン酸、プロテオグリカンなどの成分からなり、多くのシグナル分子を含むことが知られています。ECMは通常上皮組織と結合組織の境界に存在する基底膜に多く存在し、細胞の接着・生存・分化・移動を制御し、組織構築に重要な役割を果たしていることは知られていますが、発生期の脳組織の実質であるSP層になぜ豊富なECMがあるのかは謎のままでした。
研究の内容
細胞外基質(Extra Cellular Matrix: ECM)はあらゆる組織に存在し、細胞分化、形態形成や組織の維持などに重要な役割をしています。特に皮膚ではコラーゲンやヒアルロン酸などが豊富で皮膚の形状維持に重要であることは一般にもよく知られています。実は、脳が作られる際にもこのECMが重要な働きをしていることが分かりつつあります。我々の大脳皮質はびっしりと神経細胞(ニューロン)が6層に並んだ構造を取り、そのニューロン間に精密な神経回路が形成されることで精神活動などの様々な脳機能が発揮されます。その細胞の配置はお母さんのお腹の中にいる胎児期に完了しますが、正確な配置の制御にはニューロンの移動制御が重要です。
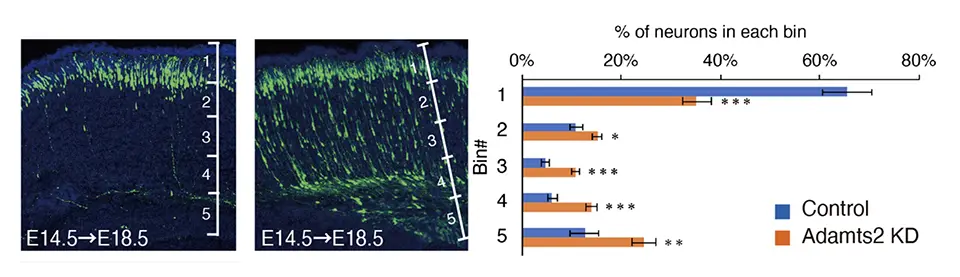
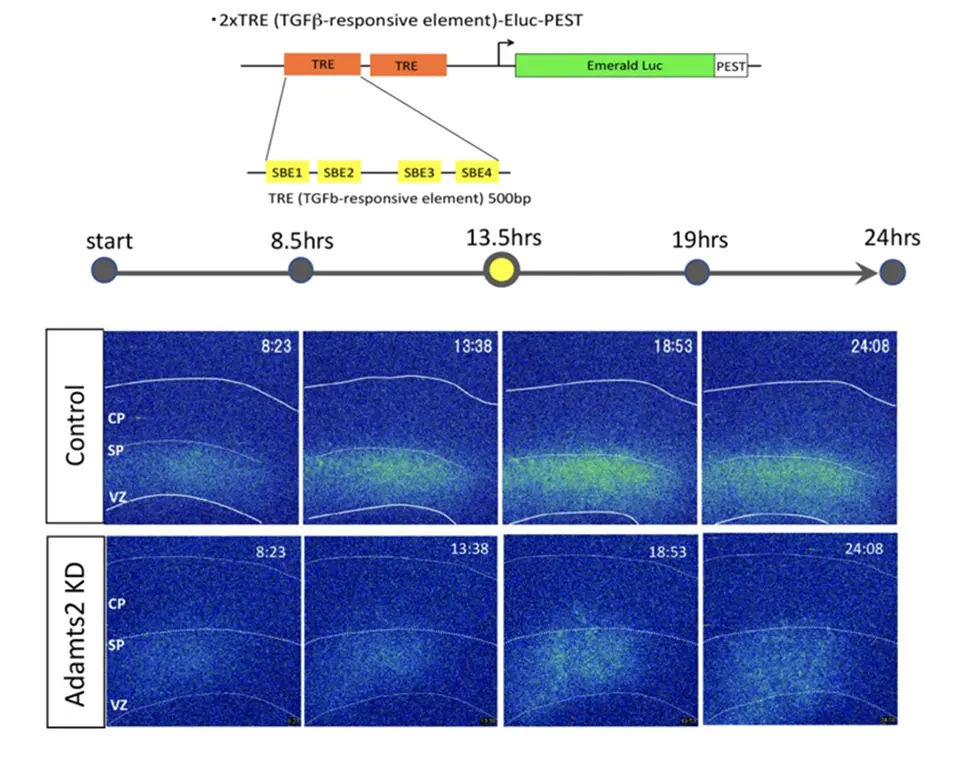
SP層は神経産生期に最初に誕生するSpNと、それを取り巻くECMからなるニューロン層で、SpNに関しては、移動ニューロンへグルタミン酸シグナルを送るというメカニズムを我々はこれまでに発見していましたが、ECMの役割に関しては全くわかっていませんでした(図1)。そこで、まずECMを人工的に分解してみる実験を行うとニューロンの形態変換と移動度が障害され、またSP層には特異的なプロテアーゼ活性があることもわかりました。そこで、移動ニューロン内でどのような遺伝子が上昇してくるかについて調べたところ、ADAMTS2と呼ばれる、細胞外で働くプロテアーゼの遺伝子発現が上昇することが分かりました。そこで、この遺伝子の発現を人工的に上昇させたり、減らしたりしたところ、細胞内のアクチンの動態が乱れ、ニューロンの移動が障害されました(図2)。ではADAMTS2はどのような基質を分解することでニューロンの移動制御に関わっているのでしょうか?我々はサSP層直下でTGF-βシグナルが実際に一過的に上昇することを、開発したモニター用のプラスミドと培養スライスを用いて発光イメージングという方法により世界で初めて観察しました。ADAMTS2遺伝子発現を抑えるとそのシグナルが観察できないことから、ADAMTS2の分解の標的がTGF-βを不活性型で保持しているECM(LTBP-1、バーシカン)であることを発見しました(図3)。
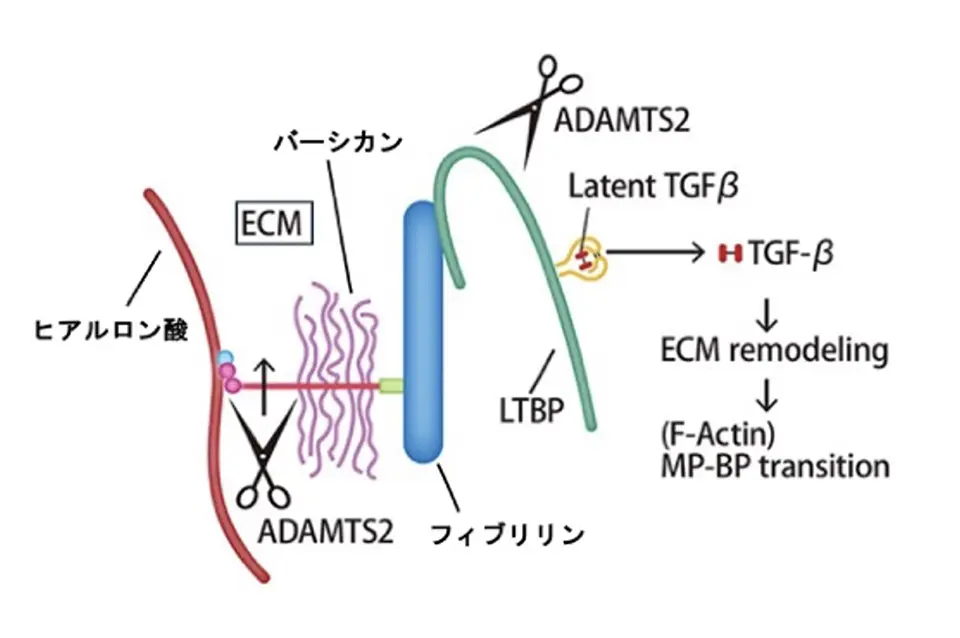
まとめると、SP層のECMに保持されている不活性型TGF-βは、LTBP1やバーシカンに結合した形で通常は不活性化されているが、新生移動ニューロンがSP層に近づいてくるとADAMTS2プロテアーゼを分泌される。するとSP層のそれらのECMを分解してECMのリモデリング(再構築)が起こり、TGF-β分子が放出し活性化する。TGF-βシグナルは、おそらくはSpNからのグルタミン酸シグナルとともに、移動ニューロン内のアクチンの重合を制御して、細胞形態と移動モードの変換を促すことが分かりました(図4)。
社会的意義・今後の展望
本研究により、脳の発生過程におけるECMの存在意義の一つを明らかにすることができました。ADAMTS2をコードする遺伝子の変異はエーラス・ダンロス症候群という疾患の原因であることが知られており、皮膚や他の組織の脆弱性を特徴とする先天性の難病です。患者さんの中には精神遅滞等の脳神経症状を示す場合も認められます、そのような症状の根底には今回発見したメカニズムが関係する可能性もあり、今後は脳発生メカニズムに加えてヒトの疾患の理解も進むことが示唆されます。
<用語解説>
- 細胞外基質:
- Extra Cellular Matrix(ECM)の日本語。組織を裏打ちする基底膜や、細胞間隙に存在する糖とタンパク質の複合体。すべての組織や臓器に存在し、複雑で動的な3次元構造を持つ。ヒアルロン酸、フィブロネクチン、コラーゲンやプロテオグリカンなどが主な構成成分である。ECMは組織の形態形成や分化、恒常性維持に必要であるほか、細胞接着の支持体としても機能する。
- ADAMTS2:
- ADAM Metallopeptidase with Thrombospondin Type 1 Motif 2の略。タンパク質を分解する酵素で、細胞外に分泌されてECMの構成タンパク質を分解する酵素のファミリーに属する。酵素活性に2価の金属イオン(主に亜鉛)を必要とするためメタロプロテアーゼと呼ばれる。
- 大脳皮質:
- 動物の脳の大脳半球の表面を覆う部分。哺乳類では大脳の広い範囲に見られる6層の神経細胞層からなる領域は、進化的に新しく獲得したと考えられることから大脳新皮質と呼ばれる。これに対し、海馬や扁桃体などの領域は非哺乳類脳でも相当する領域があり、古皮質と呼ばれることがある
- TGF-β:
- 細胞増殖・分化や細胞死など細胞の働きを調節する分泌性蛋白の一種。TGF-βは、細胞膜上に存在する特異的な2型受容体に結合すると、1型受容体と複合体を形成し、細胞の中にシグナルを伝えることができるようになる。1型受容体が活性化されると細胞内情報伝達分子であるSmad複合体は、細胞質から核に移行して標的遺伝子の転写調節領域に存在するSBE(Smad binding element)に結合し標的遺伝子の発現を制御することでシグナル伝達がおこる。
