2017年3月1日
英国科学誌 「Nature Communications」 on-line版に村上 誠 参事研究員らが 「セラミドはなぜ肌の健康に重要か? 皮膚のバリア機能に必要不可欠な新しい脂質代謝酵素の発見」 について発表しました。
セラミドはなぜ肌の健康に重要か?
皮膚のバリア機能に必要不可欠な新しい脂質代謝酵素の発見
(公財)東京都医学総合研究所の村上誠参事研究員、平林哲也主席研究員らは、脂質を代謝する酵素の生理的役割に関する研究を通じて、表皮角化細胞(皮膚の一番外側の細胞)が作り出す特殊な酵素が皮膚のバリア機能に必須の脂質成分であるアシルセラミドの生合成に関わることを初めて明らかにしました。本研究成果は、魚鱗癬やアトピー性皮膚炎などの難治性皮膚疾患の新たな診断法や治療薬の開発につながることが期待されます。
本研究は、名古屋大学の秋山真志教授、理化学研究所の有田誠リーダー、米国バンダビルド大学のAlan Brash教授らとの共同研究により、国立研究開発法人日本医療研究開発機構 (AMED) の革新的先端研究開発支援事業 (AMED-CREST) 「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」 (研究開発総括:清水孝雄) における研究開発課題 「PLA2メタボロームによる疾患脂質代謝マップの創成とその医療展開に向けての基盤構築」 (研究開発代表者:村上誠) ならびに日本学術振興会科研費 (新学術領域研究、基盤研究、挑戦的萌芽研究) の一環として行われました。なお、AMED-CRESTの研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。本研究成果は、2017年3月1日午前10時 (英国時間) に英国科学誌 『Nature Communications(ネイチャーコミュニケーションズ)』 にオンライン掲載されました。
http://www.nature.com/articles/ncomms14609
<論文タイトル>
“PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis”
(PNPLA1はアシルセラミドの生合成を制御することで皮膚バリア機能に重要な役割を担う)
doi:10.1038 /NCOMMS14609
1.研究の背景
脂質は皮膚にとって非常に大切な生体成分です。皮膚の最上層(外界に接する部位)を取り囲む表皮角化細胞は角質細胞間脂質と呼ばれる脂質(主成分はセラミド*1)の層を形成し、体内からの水分の蒸散や外界からの病原体・異物の侵入から私たちの体を守っています。これは皮膚バリア機能と呼ばれ、皮膚の最も重要な役割の一つです。特に、セラミドの中でも特殊な構造を持つアシルセラミド*2(図A)は皮膚のバリア機能に必要不可欠な成分であり、何らかの要因でアシルセラミドの生合成や代謝が乱れると皮膚のバリア機能が損なわれ、難治性皮膚疾患である魚鱗癬*3やアトピー性皮膚炎*4などの原因となります。しかしながら、アシルセラミドの生合成に関わる酵素の実体は不明でした。村上研究員らは、脂質代謝酵素群の生理的機能に関する研究を進める過程で、ヒト魚鱗癬の原因遺伝子の一つとして報告されている特殊な酵素PNPLA1が長年探し求められていたアシルセラミド合成酵素であることを発見しました。
2.研究の概要
村上研究員らは、表皮角化細胞に特異的に発現している機能未知の脂質代謝酵素PNPLA1に着目し、この酵素の遺伝子を人為的に破壊したマウス(PNPLA1欠損マウス)を作出しました。
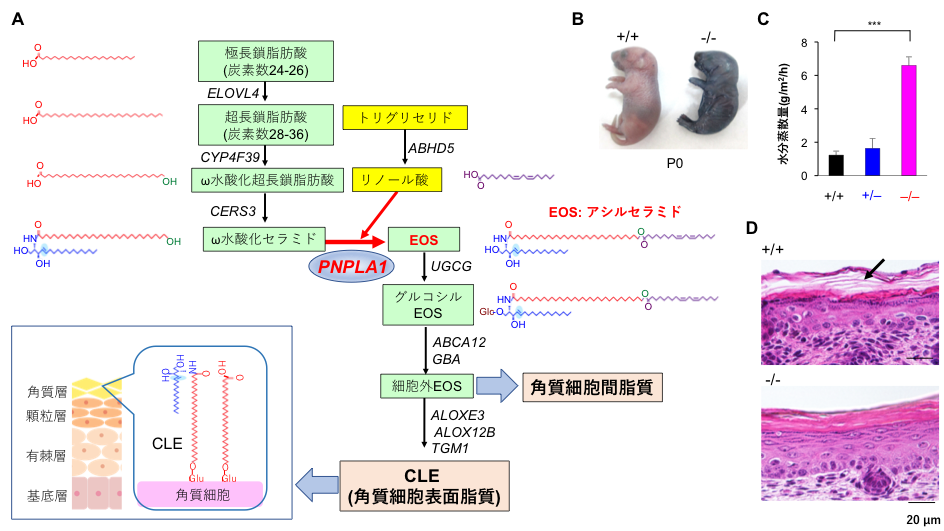
PNPLA1を発現できないマウスは正常に生まれましたが、出生直後から著しい皮膚異常を自然発症し、皮膚からの水分の喪失(皮膚バリア機能の指標)により1日以内に死亡しました(図B, C)。組織学的に、PNPLA1欠損マウスの皮膚は角質細胞間脂質が失われていました(図D)。このような表現型はマウスの魚鱗癬モデルで典型的に観察され、アシルセラミドの代謝経路に関わる遺伝子の欠損や変異において共通に見出されるものです。これまでにアシルセラミドの前駆体の生合成に関わる酵素はいくつか同定されていましたが、アシルセラミドの生合成反応そのもの(セラミドの末端にリノール酸(不飽和脂肪酸の一種)を転移する反応:図A)に関わる酵素の実体は不明でした。
そこで私たちは、PNPLA1が関わる脂質代謝を同定するために、PNPLA1欠損マウスと野生型マウスの間で皮膚の脂質の網羅的比較解析(リピドミクス*5)を行いました。その結果、PNPLA1欠損マウスの皮膚ではアシルセラミドがほぼ完全に消失しており、その代わりに前駆体(ω水酸化セラミド:図A)が蓄積していました。また、欠損マウスから表皮角化細胞を取り出して試験管内で培養すると、表皮角化細胞に特徴的な遺伝子の発現が著しく損なわれていましたが、アシルセラミドを培地に添加すると遺伝子発現が回復しました。以上の結果から、PNPLA1はこれまで未同定であったアシルセラミド合成酵素そのものであり、この酵素が欠損するとアシルセラミドの合成低下により表皮角化細胞の恒常性が乱れ、皮膚バリア機能が保てなくなると結論しました。
これまでに私たちは、脂質代謝酵素群の生体内における役割を解明してきました(Yamamoto K et al, J Exp Med 2015; Sato H et al, Cell Metab 2014; Taketomi Y et al, Nat Immunol 2013; Miki Y et al, J Exp Med 2013; Sato H et al,J Clin Invest 2010など)。本研究は、皮膚に特異的に発現している脂質代謝酵素PNPLA1の機能を初めて解明したと同時に、この酵素が長年皮膚の研究領域で探し求められていたアシルセラミド合成酵素であることを証明した初めての研究成果です。本発見は、皮膚における脂質の役割に関して新しい学術的理解を与えるとともに、皮膚バリアの破綻に起因する魚鱗癬やアトピー性皮膚炎などの難治性皮膚疾患に対する新しい診断法・治療法を提唱するものです。
3.今後の展望
皮膚におけるPNPLA1やその産物であるアシルセラミドの量は、難治性皮膚疾患の診断のための新規バイオマーカーとなる可能性があります。また、PNPLA1の発現量や機能を向上させる薬物は、難治性皮膚疾患の新規予防・治療法の開発につながることが期待できます。
用語説明
- *1 セラミド:
- 脂質には多くの分子種が存在するが、スフィンゴシン骨格(図Aの化学構造の青の部分)を持つ分子種の一群をセラミドという。皮膚の角質層にはセラミドが豊富に存在し、角質細胞間脂質の主成分として肌の潤いに欠かせない役割を持つ。若くて健康な肌にはセラミドが豊富に含まれるが、加齢とともに減少し乾燥肌の原因となる。セラミドを含むサプリメントには皮膚の水分保持能を改善する効果があると言われている。
- *2 アシルセラミド:
- 皮膚のセラミドの中には非常に長い脂肪酸(炭素数28〜36の超長鎖脂肪酸;図Aの化学構造の赤の部分)を持つ分子種がある。この超長鎖脂肪酸を持つセラミドのω末端に水酸基(図Aの化学構造の緑の部分)が結合したものがω水酸化セラミド(アシルセラミド前駆体)であり、この水酸基にリノール酸(炭素数が18で不飽和結合を2つ持つ脂肪酸:図Aの化学構造の紫の部分)が結合したものがアシルセラミドである。PNPLA1は中性脂質(トリグリセリド)の中に含まれるリノール酸をω水酸化セラミドの水酸基に転移しアシルセラミドを合成する反応を担う。ヒト遺伝性魚鱗癬の中には、このアシルセラミドの代謝系に関わる遺伝子に変異を持つ例が複数見つかっている。
- *3 魚鱗癬:
- 皮膚病の一つ。魚の鱗のように皮膚の表面が硬くなり剥がれ落ちる難治性の疾患。遺伝子異常による皮膚表面角質の形成障害が原因と考えられている。症状に応じていくつかの型(尋常性魚鱗癬、水泡型魚鱗癬、葉状魚鱗癬、道化師様魚鱗癬など)が知られるが、特に道化師型魚鱗癬は重篤で、アシルセラミドの代謝に関わる遺伝子の変異が複数見つかっている。
- *4 アトピー性皮膚炎:
- 皮膚の慢性アレルギー疾患。角層の異常に起因する皮膚の乾燥とバリア機能異常という皮膚の生理学的異常を伴い、多彩な非特異的刺激反応および特異的アレルギー反応が関与して生じる。慢性に経過する炎症と掻痒を特徴とする湿疹皮膚炎群の一疾患である。皮膚バリア機能が損なわれると抗原(アレルゲン)が体表から体内に取り込まれやすくなるため、免疫反応が過剰に活性化する。ステロイド剤、免疫抑制剤、抗ヒスタミン薬、抗アレルギー薬などが治療に用いられているほか、皮膚の保湿剤(皮膚バリアの補填)が症状の改善に有効である。
- *5 リピドミクス:
- ゲノミクス(遺伝子)、プロテオミクス(タンパク質)、グライコミクス(糖)に対応する、脂質を対象とした網羅的解析を指す。それぞれの脂質分子種の分子量が異なることを利用して、組織や細胞などの検体に存在する多種多様な脂質分子種を質量分析により一斉に同定、定量する。最近の質量分析の高感度化により、微量の脂質分子種を容易に検出することが可能となった。
【参考図】
PNPLA1の皮膚バリア機能における役割
- アシルセラミド代謝経路の全容。各反応における代謝物の構造と関連する酵素(斜体)を示す。PNPLA1はω水酸化セラミドの末端水酸基にリノール酸を転移してアシルセラミド(EOS)に変換する。EOSはさらに代謝されて細胞外に放出され、最終的に角質細胞間脂質の主成分となるとともに、その一部は角質細胞と共有結合してCLE(cornified lipid envelope: 角質細胞表面脂質)を形成する。これらの特殊な脂質構造が皮膚角質バリアに不可欠である。
- PNPLA1ホモ欠損(-/-)と野生型(+/+)の新生児マウスをトルイジンブルー染色液に浸すと、欠損マウスは皮膚バリアの喪失のため色素が体内に浸透して青く染まる。
- PNPLA1ホモ欠損(-/-)は野生型(+/+)やヘテロ欠損(+/-)の新生児マウスと比べ、皮膚バリアの喪失のため経皮水分蒸散量が著しく増加する。
- 皮膚の組織像。野生型(+/+)では角質細胞間脂質の層(矢印)が見られるが、ホモ欠損(-/-)ではこれが消失する。