2022年7月28日
幹細胞プロジェクトの北島健二主席研究員、原孝彦参事研究員、真貝美奈子研修生、安藤輝研修生らは、インターフェロン-γ/FLT3経路がヒトiPS細胞からの造血前駆細胞産生を増加させることを発見し、米国科学誌「Stem Cells」に発表しました。
ヒトiPS細胞から造血前駆細胞を効率良く作り出すための鍵となる因子を発見
当研究所幹細胞プロジェクトの北島健二主席研究員、原孝彦参事研究員、真貝美奈子研修生、安藤輝研修生らは、インターフェロン-γ/FLT3経路がヒトiPS細胞からの造血前駆細胞産生を増加させることを発見し、米国科学誌に発表しました。
- <論文名>
- “An interferon-γ/FLT3 axis positively regulates hematopoietic progenitor Cell expansion from human pluripotent stem cells”
- <発表雑誌>
- 米国科学誌『Stem Cells』
DOI:10.1093/stmcls/sxac052
研究の背景
ヒトiPS細胞(図1)は、特殊な培養条件で培養することにより、再生医療や医薬品開発、病因解析などに有用な細胞に変化(分化)させることができます。造血幹前駆細胞は免疫細胞や赤血球、血小板などの血液細胞を作り出すことができる細胞ですが、ヒトiPS細胞から現在の培養技術を用いて作り出された造血幹前駆細胞は、臍帯血や骨髄に含まれている本来の造血幹前駆細胞の特徴である骨髄再建能(注1)が極めて低いことが知られています。そこで現在、世界中でヒトiPS細胞から骨髄再建能の高い造血幹前駆細胞を作り出そうとする試みがなされています。
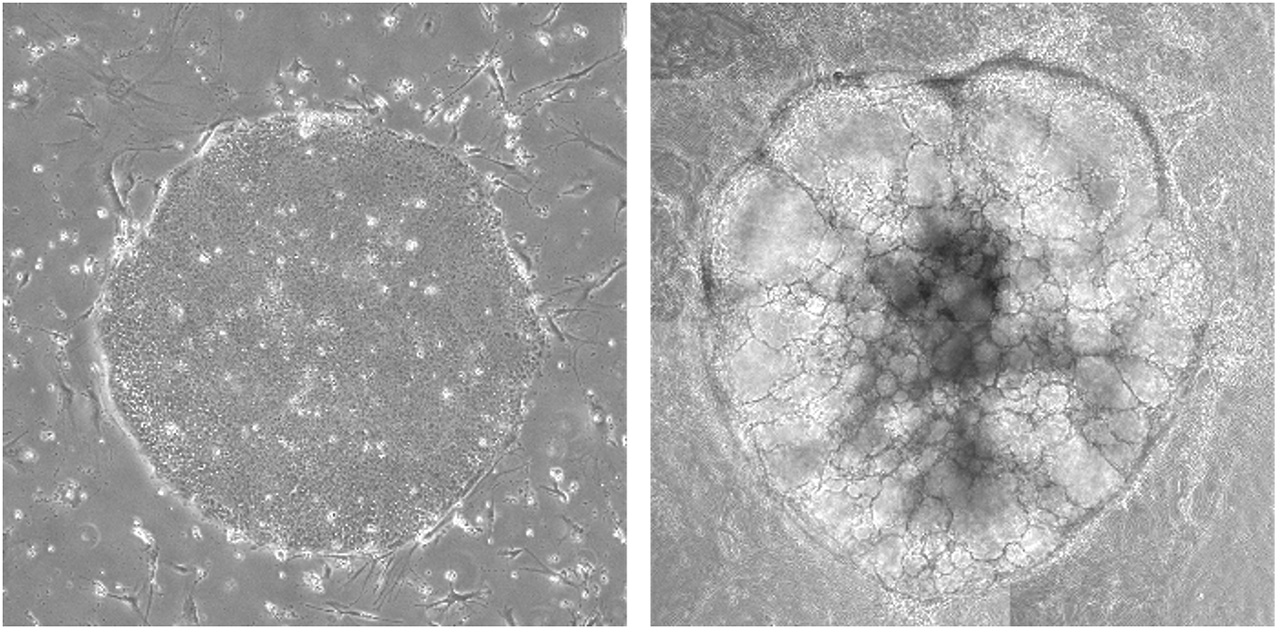
図1 ヒトiPS細胞(左)とヒトiPS細胞から作成したオルガノイド(右)
ヒトiPS細胞を特殊な培養条件で培養すると、自律的にオルガノイド様構造を構築し、この内部には造血幹前駆細胞マーカーを発現する細胞がある。研究内容
造血幹前駆細胞は、胎児期に腎臓や生殖腺(精巣や卵巣)などの元となる場所の近傍に位置する動脈の血管内皮細胞の一部から発生します。iPS細胞から作成したオルガノイド(注2;図1)を利用して、この発生過程を模倣したような培養システムを作成したところ、iPS細胞から造血幹前駆細胞マーカーを持つ細胞を得ることができました。しかし、この細胞を免疫不全マウスに骨髄移植したところ、低い骨髄再建能しか示しませんでした。そこで、この造血幹前駆細胞の特徴を詳しく解析しました。骨髄や臍帯血の造血幹前駆細胞は、通常、CD38という細胞膜タンパクを発現している造血前駆細胞を経て単球/マクロファージ・顆粒球などに分化します(図2)。このCD38発現造血前駆細胞は、極めて旺盛な細胞増殖能を有し、少数の造血幹前駆細胞から、大量の単球/マクロファージ・顆粒球を効率的に産み出すために必要な細胞です(図2)。一方、iPS細胞から作り出された造血幹前駆細胞は、CD38発現造血前駆細胞を経由せずに単球・顆粒球に直接分化する可能性が浮上しました(図2)。したがって、iPS由来造血幹前駆細胞は少数の単球・顆粒球しか作り出せないものと思われ、この細胞の骨髄再建能の低さと関連している可能性が推察されました。
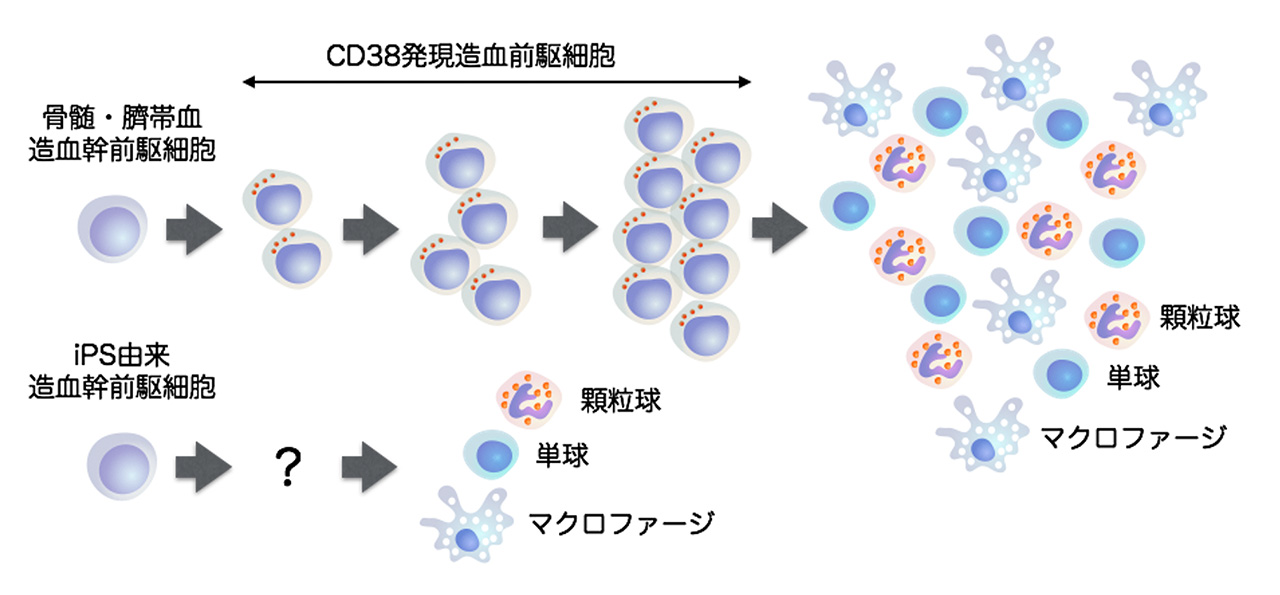
図2 骨髄・臍帯血造血幹前駆細胞とiPS由来造血幹前駆細胞の分化様式の違い。
骨髄・臍帯血造血幹前駆細胞から単球/マクロファージ、顆粒球への分化は、CD38発現造血前駆細胞による多段階増幅を経由する。一方、iPS由来造血幹前駆細胞からこれらの細胞への分化は、この分化段階をスキップする。その結果、単球/マクロファージ、顆粒球が少ない。さらに、iPS由来造血幹前駆細胞と臍帯血造血幹前駆細胞における遺伝子発現を比較したところ、iPS由来ではFLT3という遺伝子の発現が著しく低いことを発見しました。FLT3は細胞膜上に発現している受容体型チロシンキナーゼであり、造血幹前駆細胞の細胞増殖をサポートするサイトカインFLT3Lと結合することにより活性化されます。したがって、FLT3受容体の発現が低い場合、FLT3Lによる細胞増殖促進のシグナルが細胞内に伝達されません。そこで、FLT3遺伝子を発現するiPS細胞を樹立してFLT3Lを加えて分化させた結果、造血幹前駆細胞の数には大きな変化はありませんでしたが、CD38発現造血前駆細胞が大幅に増加することが分かりました。さらに、単球・顆粒球も顕著に増えていることを示唆する結果も得られました。したがって、iPS由来造血幹前駆細胞は、FLT3の発現が低いためにCD38発現造血前駆細胞を経由した単球・顆粒球分化に障害をきたすものと考えられました。
次に、iPS由来造血幹前駆細胞ではFLT3の発現が低い原因を調べました。遺伝子発現にはゲノムDNAのメチル化などのエピジェネティック修飾が大きな役割を担っています。そこで、FLT3遺伝子近傍のDNAメチル化を調べましたが大きな異常はありませんでした。このことからiPS由来造血幹前駆細胞におけるFLT3遺伝子の発現は細胞外環境からの刺激によって容易に誘導できるのではないか、という可能性が惹起され、試しにいくつのサイトカインを調べたところ、インターフェロン-γによりFLT3遺伝子の発現が活性化されることが分かりました(図3)。また、このサイトカインは、CD38発現造血前駆細胞も誘導しました(図3)。インターフェロン-γは、生後は抗腫瘍活性や抗ウイルス活性を示す炎症性サイトカインとして活性化Tリンパ球などで発現しますが、胎児期には造血幹前駆細胞の発生に関与していることが知られています。したがって、iPS細胞の培養では、インターフェロンなどが欠乏しているために、FLT3の発現が低く、そのためにCD38発現造血前駆細胞が作られないものと思われました。しかし、FLT3やインターフェロン-γは、iPS由来造血幹前駆細胞の骨髄再建能を改善することはできませんでした。一方で、本研究では臍帯血造血幹前駆細胞の体外増幅をサポートすることが知られている化合物UM171により、iPS由来造血幹前駆細胞を試験管内で増やすことに成功しました。したがって、iPS由来造血幹前駆細胞を試験管内で増やすことにより、免疫細胞や赤血球、血小板の供給源として利用できるものと期待されます。
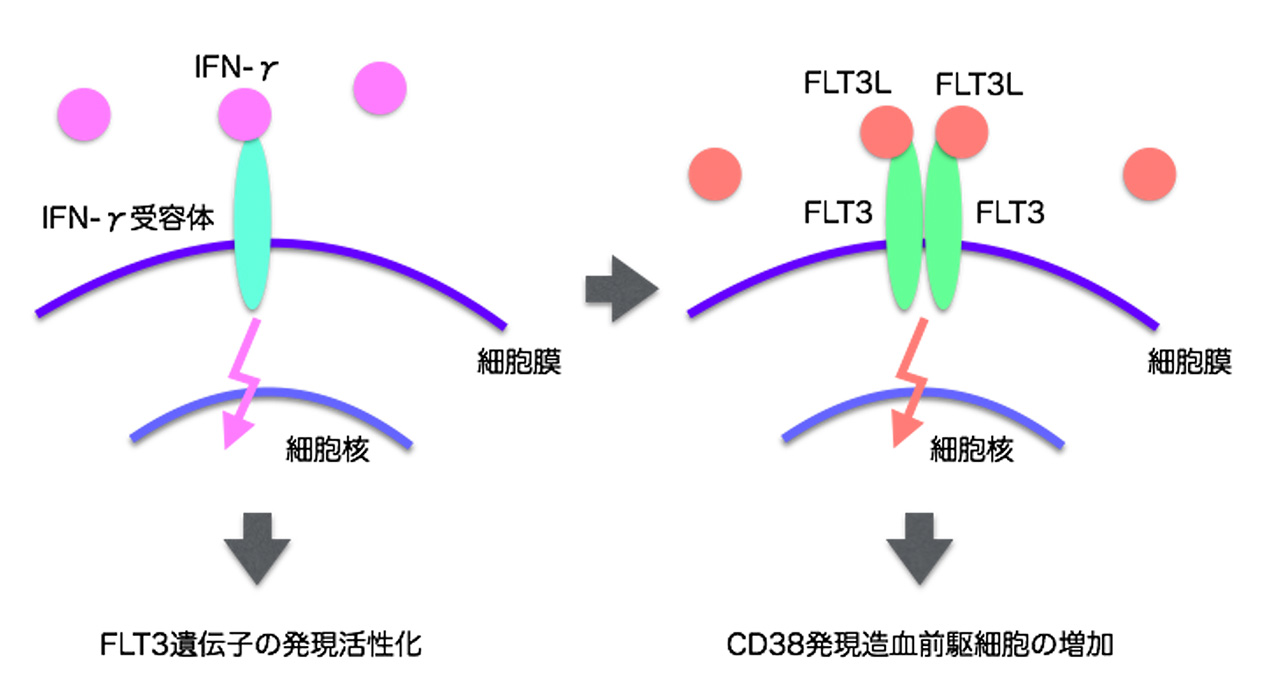
図3 iPS由来造血幹前駆細胞におけるFLT3の発現活性化と作用機序。
iPS由来造血幹前駆細胞におけるFLT3の低発現は、インターフェロン-γ(IFN-γ)により改善される。FLT3シグナルの活性化は、CD38発現造血前駆細胞を増加させる。<用語解説>
- 注1.骨髄再建能:
- 造血幹前駆細胞の主要な機能の一つ。実験的に放射線照射などにより造血系に障害を与えたマウスに移植すると造血系を再建できる能力を指す。
- 注2.オルガノイド:
- 培養下で得られるミニ臓器様の3次元的な細胞集合体。幹細胞を特殊な培養条件で培養すると作成でき、本来の臓器と似たような組織構造や機能を持つ。
