2022年7月10日
睡眠プロジェクトの本多真副参事研究員、宮川卓副参事研究員、本多芳子非常勤研究補助員らは「ナルコレプシーとその他の過眠症の発症リスクに、カルニチンパルミトイルトランスフェラーゼ1(CPT1)の活性低下が関わることを発見」について米国科学誌「SLEEP」に発表しました。
ナルコレプシーとその他の過眠症の発症リスクに、カルニチンパルミトイルトランスフェラーゼ1(CPT1)の活性低下が関わることを発見
当研究所睡眠プロジェクトの本多真副参事研究員、宮川卓副参事研究員、本多芳子非常勤研究補助員らは、カルニチンパルミトイルトランスフェラーゼ1(CPT1)の活性低下が、ナルコレプシーとその他の過眠症の発症のリスク要因となることを明らかにした研究成果について、米国科学誌『SLEEP』に発表しました。
- <論文名>
- “Low carnitine palmitoyltransferase1 activity is a risk factor for narcolepsy type 1 and other hypersomnia”
- <発表雑誌>
- 米国科学誌『SLEEP』
DOI:https://doi.org/10.1093/sleep/zsac160
研究の背景
ナルコレプシーは、睡眠発作、情動脱力発作(カタプレキシー)、睡眠麻痺及び入眠時幻覚を主な症状とする代表的な中枢性の過眠症で、レム睡眠の異常と密接に関連しています。睡眠発作は突然襲う耐え難い眠気により眠り込む発作で、情動脱力発作は、笑ったり、驚いたりしたときなど、急激な情動の変化を契機に脱力が起こる発作です。睡眠麻痺は睡眠時に体が動かせなくなる症状、入眠時幻覚は眠り際に起こる強い情動を伴う幻覚です。ナルコレプシーには遺伝要因が関わることが知られています。私たちの研究グループでは、これまでに代謝関連遺伝子のカルニチンパルミトイルトランスフェラーゼ1B(CPT1B)遺伝子近傍のSNP(一塩基多型)のrs5770917が、ナルコレプシーやその他の過眠症の発症と関わることを報告してきました。またrs5770917のリスクアリルをもつ群ではCPT1Bの発現量が有意に低いことも明らかにしています。
CPT1Bは長鎖脂肪酸のβ酸化に関わる律速酵素です。長鎖脂肪酸から変換された長鎖アシルCoAは、そのままの形ではミトコンドリア内膜を通過できません。CPT1Bにより長鎖アシルCoAはカルニチンと結合し、長鎖アシルカルニチンとなり、この形となることで、ミトコンドリア内膜を通過し、マトリックスに移動することが可能となります(図1)。長鎖脂肪酸の輸送システムはカルニチンシャトルと呼ばれています。このことから、ナルコレプシーやその他の過眠症では、長鎖アシルカルニチンの生成が抑制されていることが予測されます。そこで本研究では、炭素鎖の長さに応じたアシルカルニチン分画を、ナルコレプシー患者、その他の過眠症患者、及びコントロールとなる健常者の血液を用いて測定することで、長鎖アシルカルニチンの濃度に異常が認められるか、そしてCPT1活性が低下しているか、検証しました。さらに、次世代シークエンサーを用いたナルコレプシー患者及び健常者の血液中の遺伝子発現解析を行い、ナルコレプシー患者でカルニチンシャトルやβ酸化に関わる遺伝子の発現量の変動が認められるかについても、検討しました。
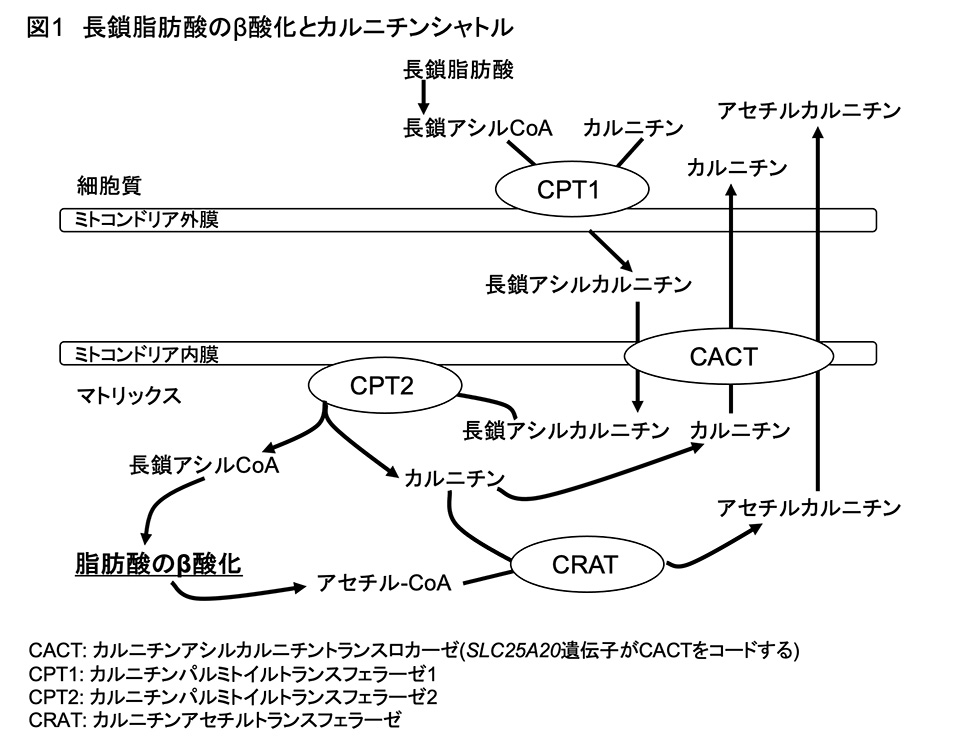
アシルカルニチン解析-CPT1活性の低下
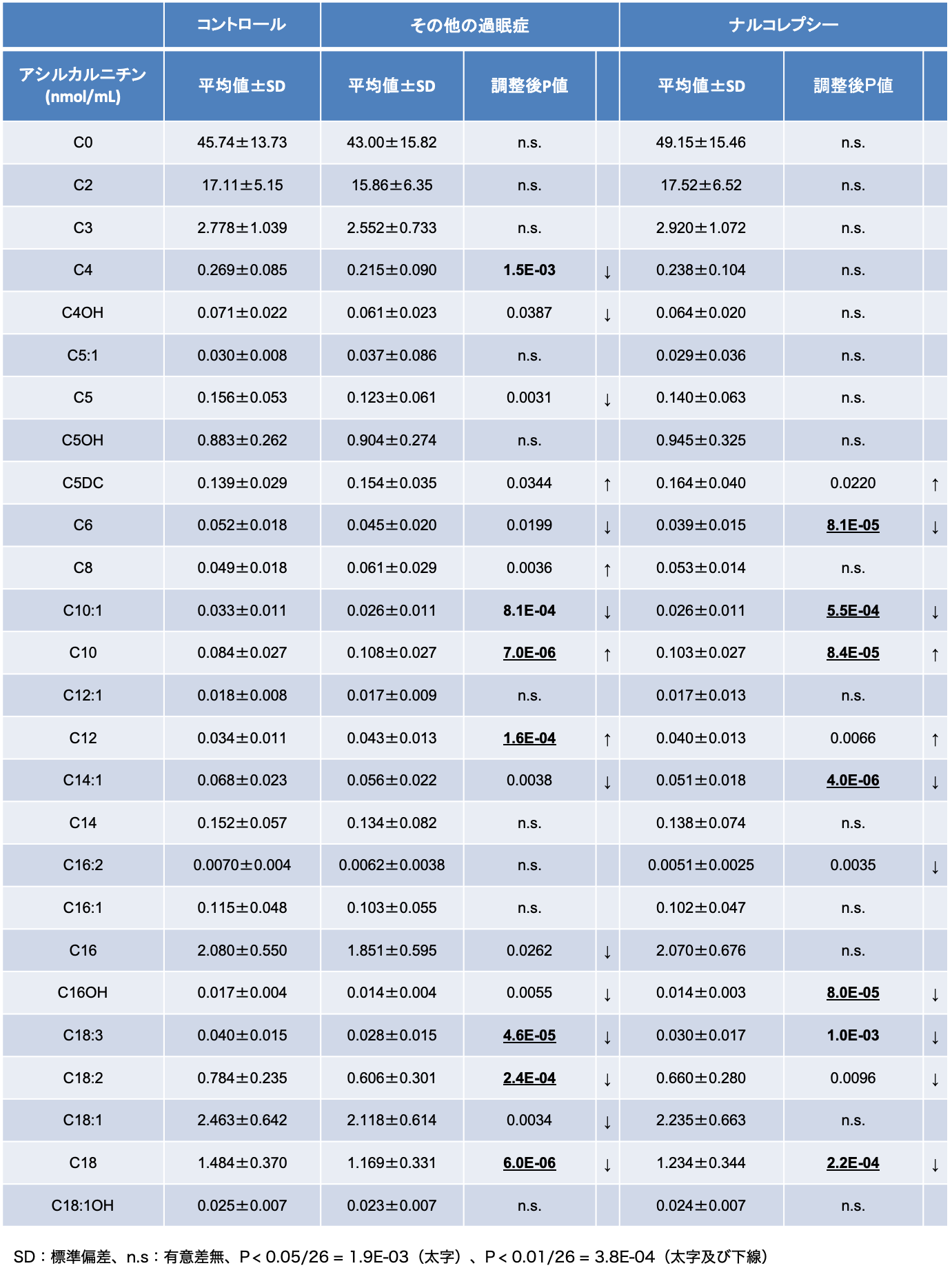
ナルコレプシー57例、その他の過眠症51例及びコントロールとなる健常者61例の血液中の25種類のアシルカルニチンの測定を、エレクトロスプレーイオン化タンデム質量分析法を用いて行いました。患者群とコントロール群の比較の際は、アシルカルニチンの測定値に影響を与える要因である年齢、性別及びBMI(body mass index)を調整した統計解析を行いました。炭素数(C)が16個から18個のアシルカルニチンが長鎖アシルカルニチンとなりますが、複数の長鎖アシルカルニチン濃度が、ナルコレプシー群だけでなく、その他の過眠症群において、低値を示していることを確認しました(表1)。
表1 アシルカルニチン解析の結果
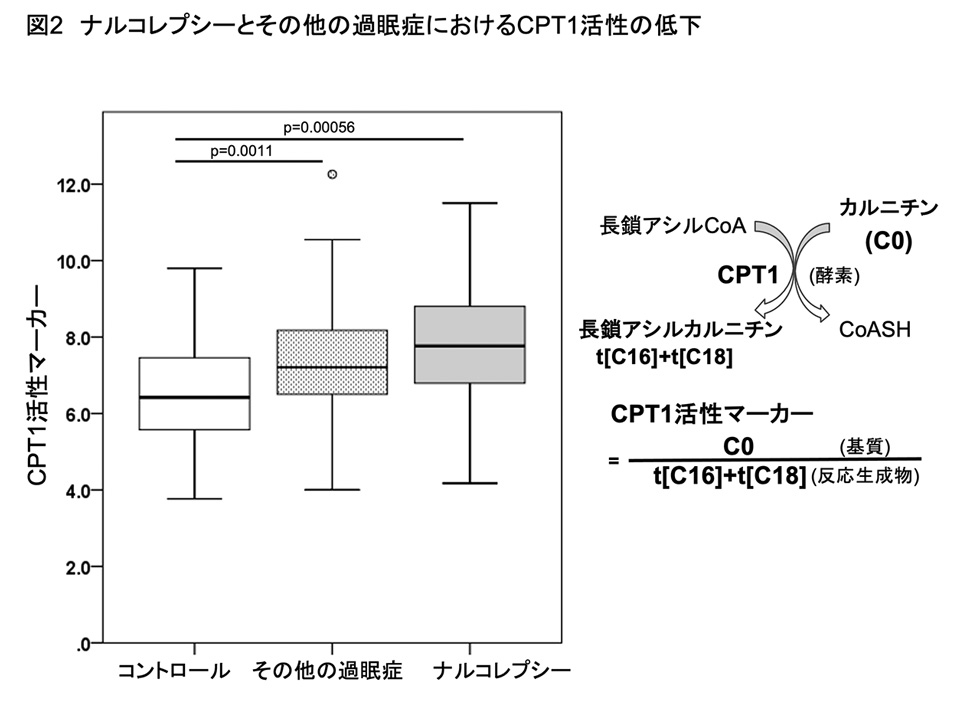
次に、CPT1活性を測定するマーカーとして、遊離カルニチン値(C0)を長鎖アシルカルニチンの合計の値で割った値を計算しました(図2)。長鎖アシルカルニチンの合計の値が分母にあることから、CPT1活性が低いほど、CPT1活性マーカーの値が大きくなります。比較検討の結果、ナルコレプシー群、その他の過眠症群の両群において、コントロール群に比べ、CPT1活性が有意に低いことが明らかとなりました。
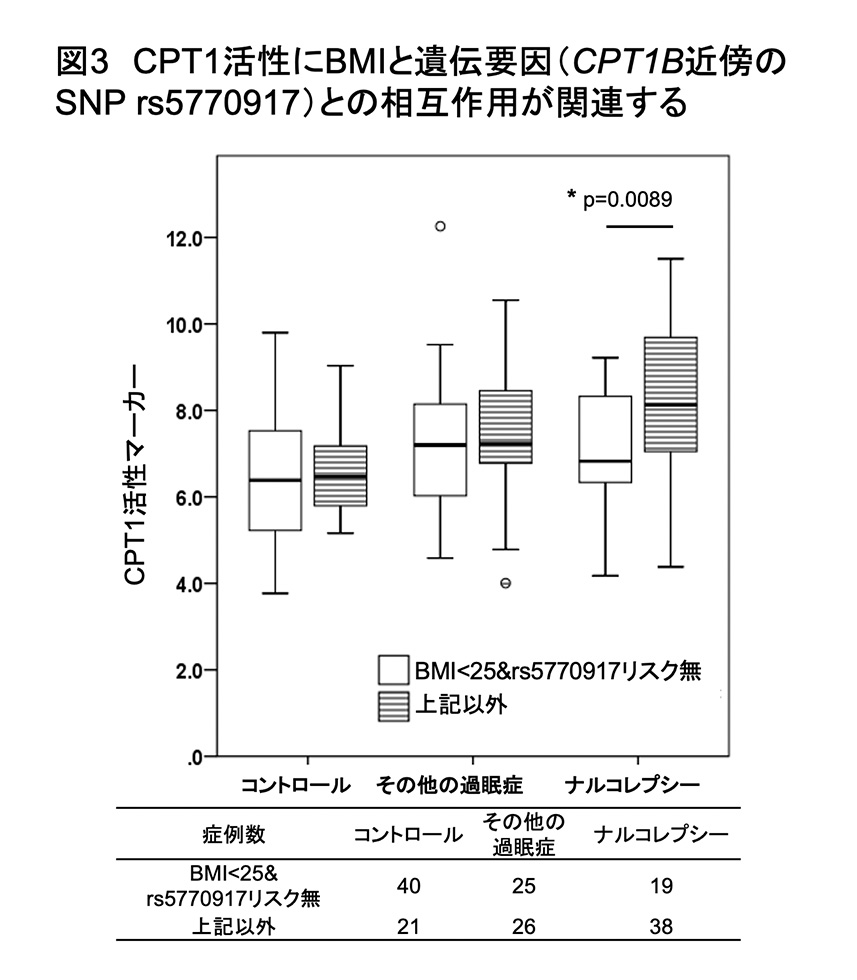
この研究を始める根拠となったことは、CPT1B遺伝子近傍のSNPのrs5770917がナルコレプシーやその他の過眠症と有意な関連を示すというゲノム研究の結果です。rs5770917のリスクアリルをもつ群ではCPT1Bの発現量が低いことがわかっているため、このリスクアリル群では、CPT1活性も低いことが想定されます。そこで、アシルカルニチンの測定を行った症例に対して、rs5770917の遺伝子型を決定し、rs5770917のリスクアリルを持つ群と持たない群で、CPT1活性マーカーの比較を行いました。想定に反して、単純な両群の比較では、CPT1活性に有意な差は認められませんでした。そこで、肥満の基準となるBMI25以上と25未満に症例を層別して解析を行いました。その結果、ナルコレプシー群の中でBMI25未満かつrs5770917のリスクアリルを持たない患者では、それ以外の患者に比べ、CPT1活性が高いことがわかりました(図3)。このことは、遺伝要因とBMIの相互作用がCPT1活性に影響を与えていることを示唆しています。
遺伝子発現解析-カルニチンシャトルに関わる遺伝子の発現低下
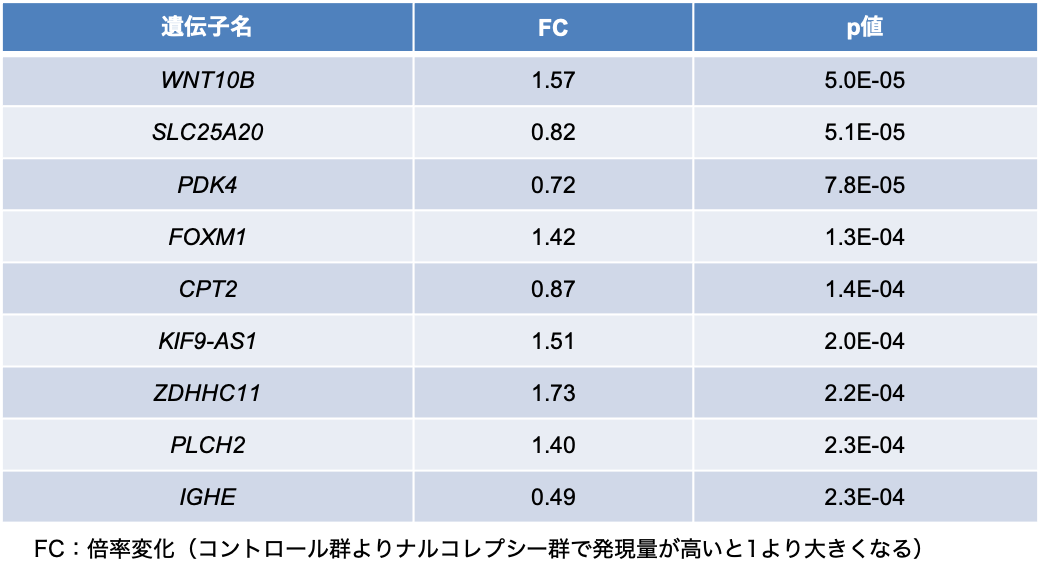
ナルコレプシー42例及びコントロールとなる健常者42例の血液中からmRNAを抽出し、次世代シークエンサーを用いて、網羅的な遺伝子発現解析を行いました。採血は未服薬で十分睡眠をとった翌朝、空腹時と条件を整えて行いました。その結果、カルニチンシャトルに関わる遺伝子であるSLC25A20遺伝子(CACTをコード)とCPT2遺伝子の発現量が、ナルコレプシー群において低く、全検出遺伝子の中で、それぞれ2番目と5番目に低いP値を示していました(表2)。いくつかのパスウェイ解析を行ったところ、想定通り、カルニチンシャトルが有意なパスウェイとして、検出されました。一方、CPT1B遺伝子は、ナルコレプシー群とコントロール群で有意な差がありませんでした。しかし、前述の通りCPT1B遺伝子近傍のSNPのrs5770917は、ナルコレプシーやその他の過眠症の発症と関連があるだけでなく、rs5770917のリスクアリルはCPT1B遺伝子の発現量低下と関連します。つまり発症と関連する遺伝要因によってCPT1B遺伝子の発現量は抑制されていることがわかります。SLC25A20遺伝子とCPT2遺伝子近傍にはナルコレプシーやその他の過眠症の発症と関連するSNPは同定されていません。本研究で見出されたナルコレプシー群におけるSLC25A20遺伝子とCPT2遺伝子の発現低下は、遺伝要因ではない、別の要因によって、引き起こされていると考えられます。
表2 ナルコレプシー群とコントロール群の比較で発現量変化が認められた上位10遺伝子
まとめ
アシルカルニチン解析及び遺伝子発現解析の結果から、長鎖脂肪酸の代謝の機能低下がナルコレプシーやその他の過眠症の病態生理に深く関わることがわかりました。本研究では血液サンプルを用いたアシルカルニチン解析や遺伝子発現解析を行いました。このような血液中での変化が、脳の睡眠中枢にどのように影響を与えているかを解明することが今後の課題となります。
