2022年12月9日
脳神経回路形成プロジェクトの丸山千秋プロジェクトリーダーらは「脳血管のパターン形成にサブプレートニューロンの神経活動が影響する」についてLife に発表しました。
脳血管のパターン形成にサブプレートニューロンの神経活動が影響する
〜血管内皮細胞移動のシミュレーションに関する論文が掲載〜
当研究所脳神経回路形成プロジェクトの丸山千秋プロジェクトリーダーは、九州大学医学研究院の今村寿子助教および神戸学院大学の水谷健一教授らの研究グループとの共同研究で、大脳皮質の発生過程における血管のパターン形成の際の、血管内皮細胞の移動を制御する仕組みを、生物学と数理モデル・コンピューターシミュレーションを用いた研究手法により明らかにしました。国際科学雑誌『Life』に2022年12月9日(水)に掲載されました。
当研究所は、実験的な部分を担当し、血管形成でもサブプレートニューロン活動が重要であることの解明に貢献しました。
- <論文名>
- “Computational Model Exploring Characteristic Pattern Regulation in Periventricular Vessels”
(脳室周囲血管の特性パターン制御を探索する計算モデル) - <発表雑誌>
- Life 2022, 12(12), 2069
DOI:https://doi.org/10.3390/life12122069
研究の背景
胎生期における血管新生の過程では、血管内皮細胞(Endothelial cells ;EC) が分裂、分岐、伸長などを繰り返しながら血管に特徴的な枝分かれ構造を形作っていきます。胎生期の脳発生過程ではサブプレート(SP)層の上部では垂直方向に並行して走行する血管のパターンであるのに対し、SP層の下方ではハニカム構造を取ることが知られていますが(図1)、なぜこのようなユニークな血管走行パターンになるのかは未解明でした。
研究の概要
今回研究グループは、エージェントベースの数理モデルシミュレーションにより、血管内皮細胞の動きをコンピューター上で再現することを行いました。エージェントとして血管内皮細胞が連なって動く際に先端に位置する細胞(Tip cell)とそれに追随する細胞(Stalk cell)を設定し、その基本的な動き方を規定しました(図2)。ECの分裂と血管の分岐はランダムにおこることを想定した上で、先端細胞が走化性(kc)により垂直方向へ移動すること、および他の細胞から反発される(kb)ことをパラメータとして入れこんでシミュレーションを実行しました。
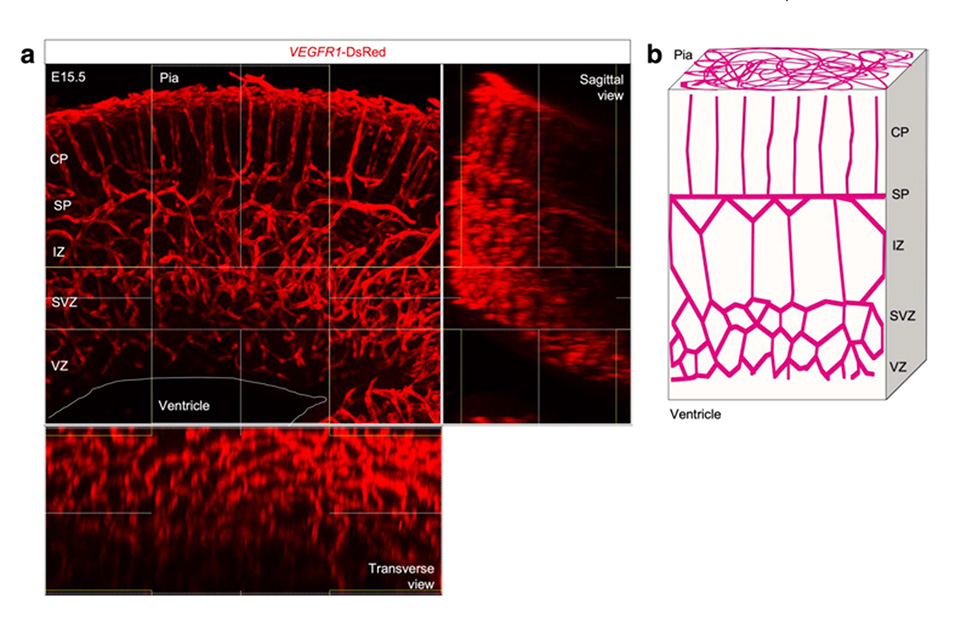
図1 マウス胎生期大脳皮質の血管パターン
SP層を境に上部は並行な走行、下部はハニカム構造をとる。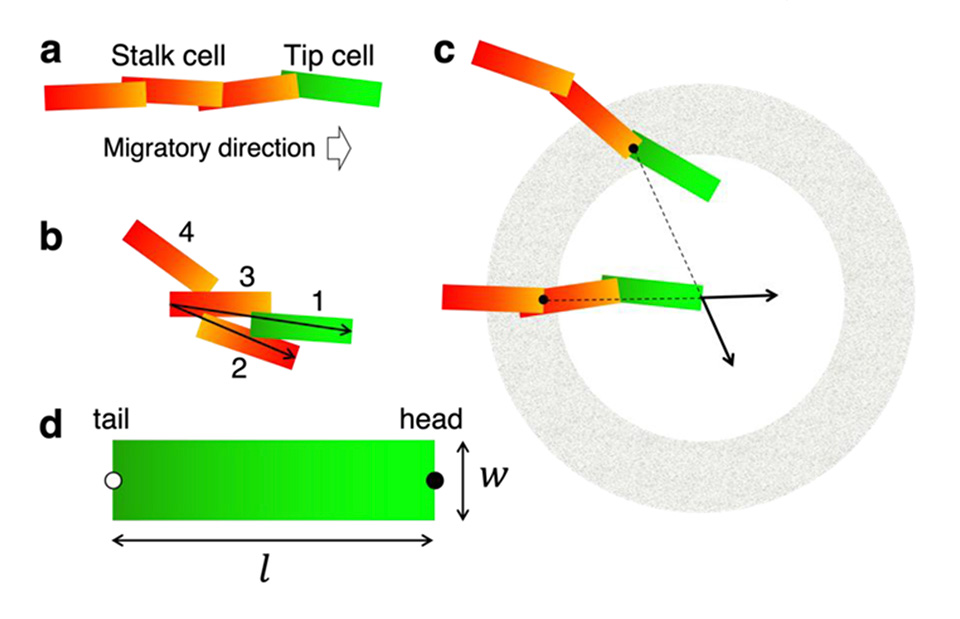
図2 数理モデルのエージェントとして先端細胞
(Tip cell)と茎細胞(Stalk cell)と反発領域(灰色)を設定した。その結果、kcとkbの度合いにより血管パターンが変わり、kcが高くてkbが低い場合には分岐の少ない、一方向性の血管の走行パターンを取り、逆にkcが低くてkbが高くなるほど分岐が増えることが明らかになりました。この結果から、発生期大脳皮質においてkcやkbの度合いがSP層の上部と下部では明らかに違うのではないかということがわかってきました(図3)。

図3 走化性(kc)と反発力(kb)の強さによって血管のパターンが変わる
走化性が低く、反発力が高いほど血管の枝分かれが増え、走化性が高く反発力が低いほどまっすぐで並行に走るパターンになる。SpNは早期から神経活動をして神経細胞の移動や視床からの軸索誘導などを担っています。そこで、血管の細胞移動にもその活動が何らかの影響を及ぼすのではないかと仮説をたて、胎生10日目に、Kir2.1 発現プラスミドを子宮内エレクトロポレーションでSpNに導入することで神経活動を抑制し、血管の走行パターンへの影響を調べました。その結果、同じ脳でもKir2.1 を導入した側と導入しなかった反対側で明らかに血管パターンが変わることを発見しました。すなわちKir2.1導入した方では正常の血管パターンが乱れ、CPにおいても血管の枝分かれが亢進しました(図4)。
この結果は、SpNの神経活動がECの走化性や反発力に何らかの影響を与えることで正常な血管パターンを形成していることを示唆しています。
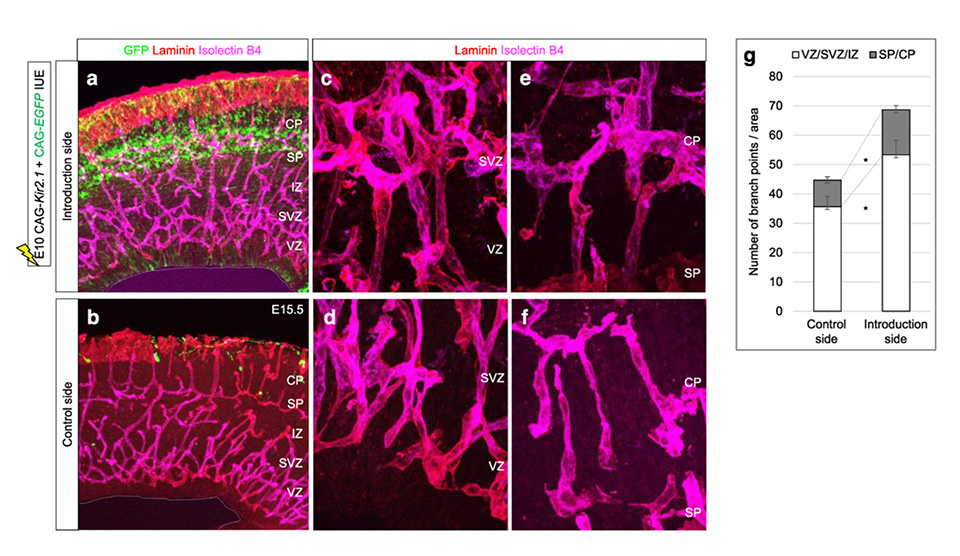
図4 SpNの神経活動をKir2.1 過剰発現により抑制すると血管のパターンが乱れた
a-f) Kir2.1 発現ベクターをE10の子宮内エレクトロポレーションでSpNへ導入すると遺伝子導入していない側と比べてCPの並行な血管パターンが乱れて枝分かれが増える。 g)分岐した枝の数をカウントしたグラフ。*P<0.05今後の展望
本研究は、先天性疾患である脳動静脈奇形等の胎児期の脳血管形成異常からおこる難治疾患のメカニズムの理解やその治療法への展望が期待できます。
<用語解説>
- 血管内皮細胞:
- 血管内側の表面を覆う細胞。 血管が新生される際には増殖しながら移動し、血管を形成する。血液と周囲の組織との間で、栄養素や老廃物、酸素や二酸化炭素などの物質交換を担う。 内皮細胞の機能低下はいわゆる動脈硬化の誘因となる。
- エージェントベースの数理モデル:
- コンピュータによるモデルの1種。自律的なエージェント(細胞や個体であることもあれば、組織やグループのような集合体であることもある)の行動特性と相互作用を、それらがシステム全体に与える影響を評価するためのシミュレーション。個体ベースモデルと呼ばれることもある。 複数のエージェントが同時に活動し、相互作用する状況をシミュレートすることによって、複雑な現象を再現し、予測することを目指すモデリング方法。
- 走化性:
- 単一の細胞や多細胞生物の組織構築の際、周囲に存在する特定の化学物質の濃度勾配に対して方向性を持った行動を起こす現象で、化学走性(かがくそうせい)ともいう。対象となる化学物質の濃度勾配に対し、それが高い方向へ運動することを「正の走化性」とよび、その逆への運動は「負の走化性」とよばれる。 血管新生の際には、血管内皮細胞が受容体を発現することで、サイトカインの一種であるVEGF(Vascular endothelial growth factor; 血管内皮細胞増殖因子)に対する走化性があることが知られている。
- Kir2.1:
- 内向き整流性カリウムチャネル。発現する遺伝子を神経細胞に過剰発現することにより神経活動を抑制することができる。
