2022年12月8日
視覚病態プロジェクトの原田高幸 プロジェクトリーダーらは「緑内障モデルにおいて病態の進行を予防し、視神経を再生する、新しい遺伝子治療ベクター」についてMolecular Therapy に発表しました。
緑内障モデルにおいて病態の進行を予防し、視神経を再生する、新しい遺伝子治療ベクター
当研究所 視覚病態プロジェクトの原田高幸プロジェクトリーダーは、西島義道研究員(東京慈恵医大眼科)、本田紗里研究員(順天堂大学眼科)、北村裕太研究員(千葉大学眼科)らと共同で、「緑内障モデルにおいて視覚の保護と視神経軸索の再生を可能とする細胞膜結合型Trk受容体」の作製に成功しました。本研究成果は緑内障や視神経外傷などに対する新たな治療につながることが期待されます。
この研究成果は、米国遺伝子細胞治療学会の機関誌「Molecular Therapy」のオンライン版に2022年12月2日付けで先行公開されました。
- <論文名>
- “Vision protection and robust axon regeneration in glaucoma models by membrane-associated Trk receptors”
(細胞膜結合型Trk受容体による、緑内障モデルにおける視覚の保護と強力な軸索再生) - <発表雑誌>
- Molecular Therapy
DOI:https://doi.org/10.1016/j.ymthe.2022.11.018
研究の背景
緑内障は日本では第1位、世界でも第2位の失明原因です。現在のところ緑内障の治療は眼圧を下げる目薬や手術によって行われていますが、それでも進行してしまう方も多く、新たな治療法の開発が求められています。そこで視覚病態プロジェクトでは緑内障モデル動物を用いて、遺伝子治療によって緑内障を抑制できないか検討しました。
研究の概要
研究グループでは以前から、神経保護作用がある神経栄養因子に注目した研究を行ってきました。例えば脳由来神経栄養因子(BDNF)の眼球内投与は網膜の神経保護に有用ですが、有効期間が短いのが難点です。それを解決するには、BDNFの受容体[1]であるTrkBを用いた遺伝子治療が考えられますが、TrkBの分子量が大きいために、遺伝子治療用ベクター[2]として活用されるアデノ随伴ウイルス(AAV)に組み込んでも、高発現させることが困難でした。そこで本研究ではTrkBの活性部位のみを切り出し、人工的に細胞膜に結合させることによって、常に活性型となるTrkB分子を開発しました(図1)。この方法では分子量が小さくなるために全長TrkBよりも高発現が得られ、しかもBDNFが無くても、常にTrkBシグナルを活性化させることが可能になります。
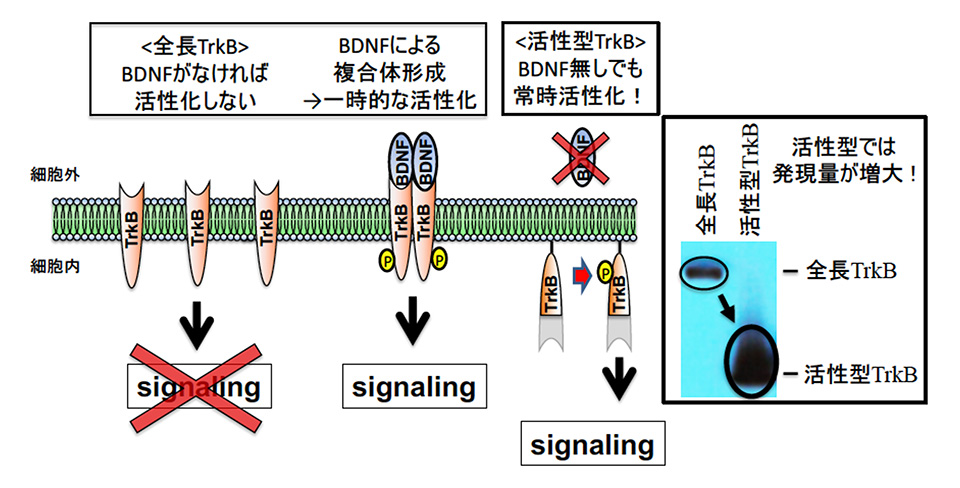
次にこの活性型TrkB分子を組み込んだ遺伝子治療ベクター(AAV-F-iTrkB)を、緑内障モデル動物の眼内に注射しました。このマウスでは生後3週から12週にかけて緑内障が進行しますが、生後10日目に遺伝子治療を行った場合には、生後5週と12週で多くの網膜神経節細胞が生き残っていることがわかりました(図2)。
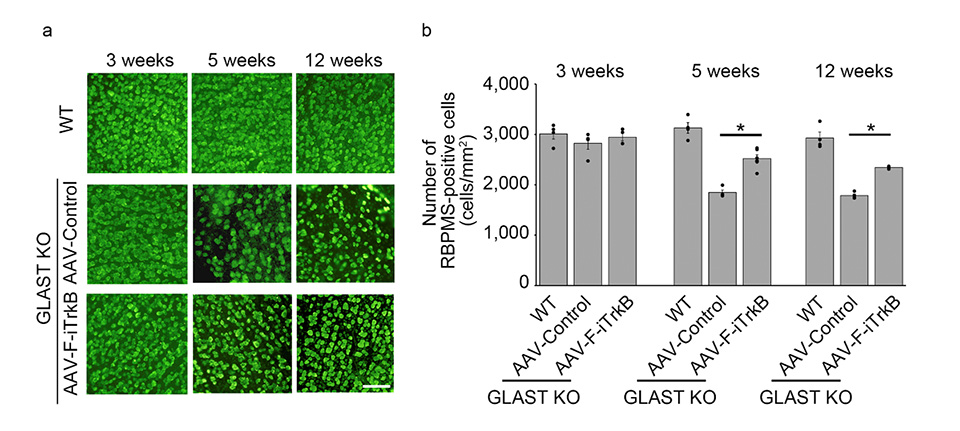
図2 緑内障モデルに対する遺伝子治療の神経保護効果
a) 緑内障モデル(GLAST KO)マウスでは生後5週、12週で網膜神経節細胞が減少するが(中段)、遺伝子治療群(下段)では普通のマウス(WT、上段)と同程度に多くの細胞が観察された。b) a) の細胞数をカウントしたグラフ。*P<0.05。
さらに視神経損傷の外傷モデルマウスにおいても同様の遺伝子治療を行い、一旦傷んだ視神経軸索[3]を再生できるかどうかを調べました。通常は再生線維がほとんど観察されません(図3、上段)が、遺伝子治療を行うと2週間(図3、中段)、4週間(図3、下段)と時間が経過するにつれて、多くの再生線維が伸長しました。また4週間後では一部の線維が視交叉[4]に到達することが確認されました(図3、下段)。
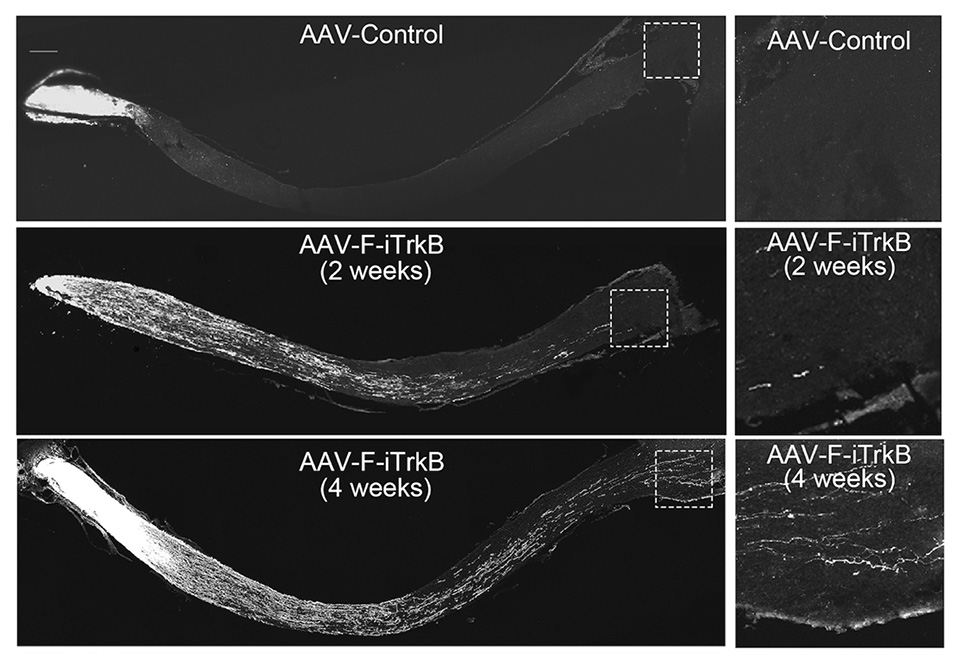
図3 視神経損傷モデルに対する遺伝子治療の視神経再生効果
(左)無治療の2週間後(上段)、遺伝子治療の2週間後(中段)と4週間後(下段)における再生した視神経軸索の観察。(右)左図中の四角部分(視交叉付近)の拡大図。遺伝子治療の4週間後には、多くの再生軸索が視交叉に到達していることが確認できる。
視神経損傷モデルでは、残念ながら視力を回復させることはできませんでした。そこで次に、軸索の再生距離が短くても視機能が改善しやすいモデルとして、視覚中枢である上丘において視覚経路を切断したマウスを作製しました(図4、上段)。このマウスの眼球内に遺伝子治療ベクターを投与すると、多くの再生線維が切断部位を超えて、上丘内に到達しました(図4、中段)。視機能が回復しているかどうかを調べるために視機性動眼反射[5]を計測したところ、遺伝子治療群では部分的ながら、改善することが確認できました(図4、下段)。
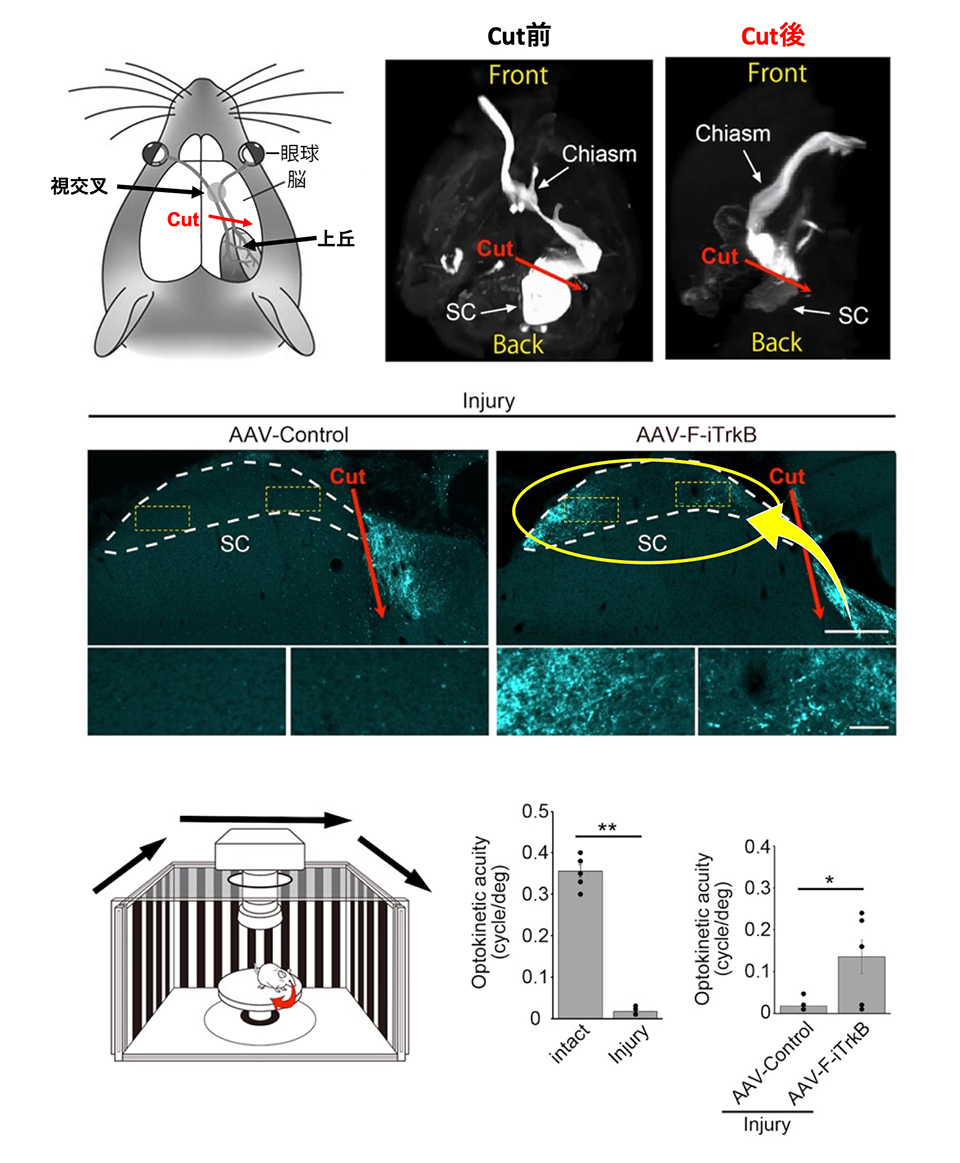
図4 上丘損傷モデルに対する遺伝子治療による視機能の回復
(上段)上丘(SC)損傷後の個体では、眼球に投与した色素が障害部位で途絶している。(中段)右の遺伝子治療後の個体では、上丘内に多数の再生線維が観察された(黄色円内)。
(下段)上丘損傷によって視機性動眼反射は大きく低下するが、遺伝子治療後の個体では部分的な回復が確認された。
今後の展望
緑内障においては現在のところ眼圧を降下させる以外の治療法がなく、また緑内障や外傷によって傷んだ視神経は再生できないと考えられてきました。今回の結果は、生き残っている網膜神経節細胞に活性型TrkBを導入する遺伝子治療を行うと、緑内障の進行を抑制できたり、変性した視神経を再生できる可能性を示しています。今後は遺伝子治療や細胞移植を含めた、総合的な治療法の発展が期待されます。
<本研究の主な助成事業>
本研究は日本学術振興会(JSPS)科学研究費 挑戦的萌芽(開拓)・基盤研究、公益財団法人 武田科学振興財団・上原記念生命科学財団・内藤記念科学振興財団・鈴木謙三記念医科学応用研究財団などの支援を受けて行われました。
<用語説明>
- [1] 受容体
- 細胞の表面などに存在して、外部の刺激を細胞内へ伝達する役割をもつタンパクです。特定の物質と結合することで細胞内シグナルを活性化して、遺伝子発現などを制御します。BDNFが結合する受容体はTrkBであり、TrkBは網膜神経節細胞にも強く発現しています。
- [2] 遺伝子治療用ベクター
- 治療目的のタンパクを発現させるための遺伝子を運搬するものです。本研究では遺伝子治療ベクターとしてアデノ随伴ウィルスを活用しています。アデノ随伴ウィルスは非増殖性で、染色体にも組み込まれないため、一過性の発現となります。このように安全性が高いことから、アデノ随伴ウィルスは遺伝子治療ベクターとして注目されています。
- [3] 軸索
- 神経細胞から伸びる長い突起です。軸索の突起先端はシナプスによって次の神経細胞に結合します。網膜神経節細胞から伸びた軸索は、約100万本が集まって視神経を形成します。視神経は非常に長く、眼球から脳まで到達しており、網膜で受けた映像情報を脳へ伝達する重要な役割を持っています。
- [4] 視交叉
- 両眼から伸びた視神経が交叉する部位を視交叉といいます。マウスでは眼球から視交叉までの距離が約5mm程度です。図4の左上のイラスト内に場所を示しました。
- [5] 視機性動眼反射
- 移動する物体を見ると網膜上で画像のブレがおきますが、これを抑制するための反射として起きる眼球運動のことです。つまり移動する物体が見えている場合には、この眼球運動が起きるため、視機能の検査として、動物などでも使用することができます。
