2022年2月1日
視覚病態プロジェクトの郭 暁麗 主任研究員、原田高幸 参事研究員らは「グリア細胞に発現するASK1が神経炎症を制御する仕組み」について米国科学誌「PNAS」に発表しました。
ASK1シグナルは神経炎症におけるグリア間相互作用を病期特異的に制御する
当研究所 視覚病態プロジェクトの郭 暁麗 主任研究員、原田高幸 参事研究員らは東京大学 一條秀憲教授、長崎大学 武田弘資教授らと共同で、「グリア細胞に発現するASK1が神経炎症を制御する仕組み」を米国科学雑誌「PNAS」に発表しました。本研究成果は多発性硬化症やそれに伴う視神経炎などの新たな治療につながることが期待されます。
この研究成果は、2022年2月1日に米国科学誌「PNAS」のオンライン版に掲載されました。
- <論文名>
- "ASK1 signaling regulates phase specific glial interactions during neuroinflammation"
(ASK1シグナルは神経炎症におけるグリア間相互作用を病期特異的に制御する) - <発表雑誌>
- Proceedings of the National Academy of Science of the United States of America (PNAS)
DOI:10.1073/pnas.2103812119
URL:https://www.pnas.org/content/119/6/e2103812119
研究の背景
多発性硬化症は中枢神経組織に炎症性脱髄病変が生じる病気で、視覚障害や運動障害などが主な症状です。国内の患者数は14,000人を超えていますが、現在でも治療が難しく、詳しい原因も解明されていないことから、厚生労働大臣が定める指定難病のひとつになっています。
研究グループでは以前から、ストレス応答性分子であるapoptosis signal-regulating kinase 1(ASK1)という分子に注目しています。2010年にはASK1が欠損したマウスを用いて多発性硬化症のモデル動物であるEAE(実験的自己免疫性脳脊髄炎)を作製したところ、視神経炎や脊髄炎が軽症化することを見出しました。
https://www.igakuken.or.jp/retina/topics/topics3.html >>
しかしEAEには神経細胞だけでなく、ミクログリア、アストロサイトなどのグリア細胞や、免疫応答に関係するT細胞、樹状細胞など多くの細胞が関与することから、ASK1がいつ、どのようなタイミングで働くのか、詳しいことは不明のままでした。
研究の概要
本研究ではより詳細な検討を行う目的で、新規に5種類の細胞種特異的なASK1欠損マウスを作製しました(図1)。そして各々のEAEマウスを作製して脊髄炎の重症度を解析した結果、ミクログリアおよびアストロサイトに発現するASK1が脊髄炎を重症化させる一方、T細胞や樹状細胞のASK1による影響は少ないことがわかりました(図2)。
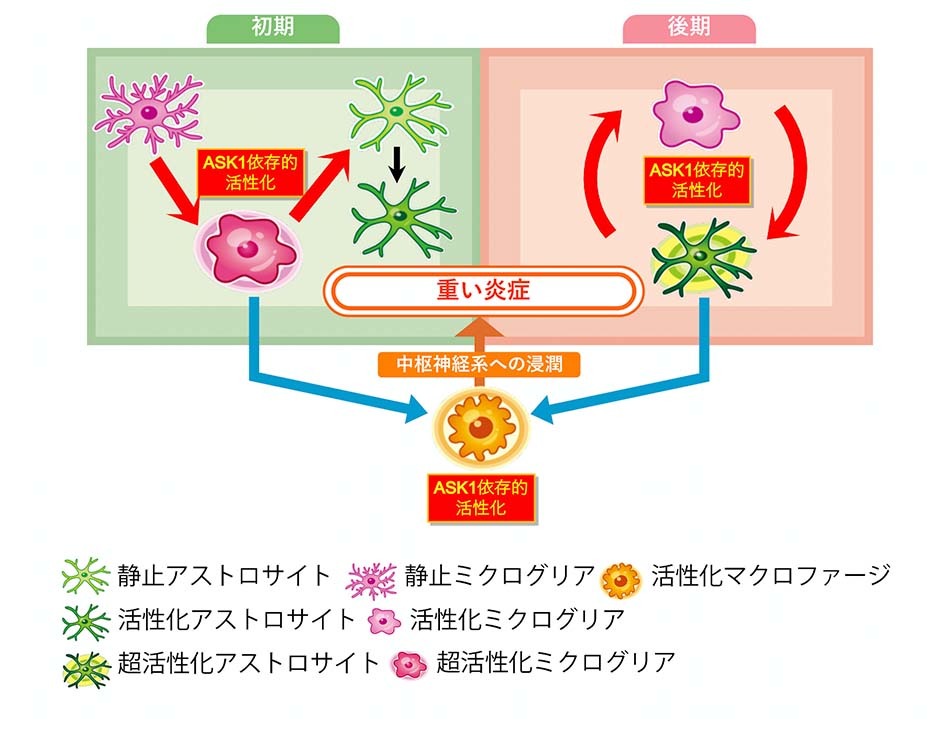
特にミクログリアからASK1が欠損したマウスでは、初期からEAEの軽症化が観察されました。EAEマウスではミクログリアが神経炎症を増悪させる「活性型ミクログリア」に変化し、炎症性サイトカイン(TNFαなど)等を産生することにより、強い神経毒性を持つ「活性型アストロサイト」を誘導することが報告されています。しかしミクログリアからASK1が欠損したEAEマウスでは、ミクログリアおよびアストロサイトの活性化が抑制されていたことから、両細胞の活性化にはミクログリアに発現するASK1が必要なことがわかりました。
一方、アストロサイトからASK1が欠損したマウスではEAEが後半になってから軽症化しました。しかし普通に発症するのに、途中から軽症化する理由がわかりません。そこでアストロサイト特異的な遺伝子変化を観察できる特殊なマウス(RiboTagマウス)を用いた検討を行いました。その結果、アストロサイトではEAEの初期よりも後期において、炎症性サイトカインの産生が高まることがわかりました。
またアストロサイトからASK1が欠損したEAEマウスでは、アストロサイトだけでなくミクログリアの活性化も抑制されていました。これはアストロサイトからの炎症性サイトカイン等の産生が低下することで、後期にはミクログリアの活性も維持できなかったことを示しています。
以上からASK1は病期によってミクログリア−アストロサイト間の相互作用を変化させつつ(初期はミクログリア→アストロサイト、後期はアストロサイト→ミクログリアの順に活性化)、神経炎症の悪化や維持に関わることが示されました(図3)。
今後の展望
多発性硬化症やそれに伴う視神経炎には完全な治療法がなく、その再発も問題になっています。今回の結果はグリア細胞に発現するASK1の活性化を抑制することにより、神経炎症を軽症化できる可能性を示しています。したがって今後はASK1が、多発性硬化症や視神経炎などの新たな治療標的となることが期待されます。
<本研究の主な助成事業>
本研究は日本学術振興会(JSPS)科学研究費 挑戦的萌芽(開拓)・基盤研究、公益財団法人 武田科学振興財団・上原記念生命科学財団・内藤記念科学振興財団・鈴木謙三記念医科学応用研究財団などの支援を受けて行われました。
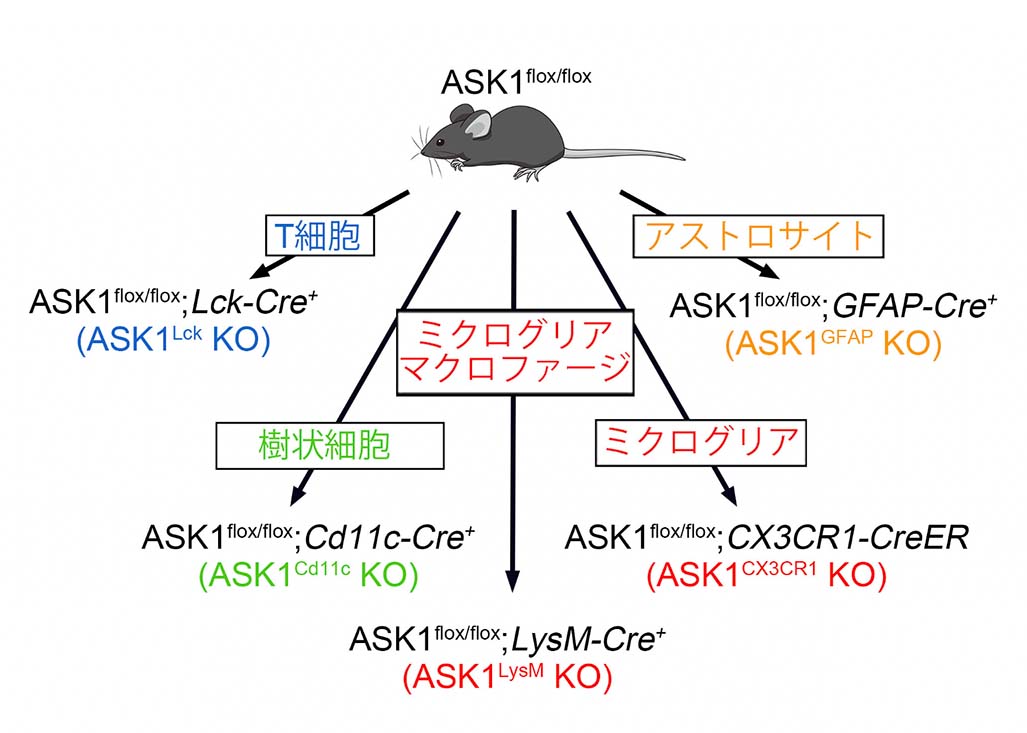
図1: 5種類の細胞種特異的なASK1欠損マウスの作製
ASK1flox/floxマウスと5種類のCreマウス(T細胞、樹状細胞、ミクログリア・マクロファージ、ミクログリア、アストロサイト)をそれぞれ掛け合わせ細胞種特異的なASK1欠損マウスを作製した。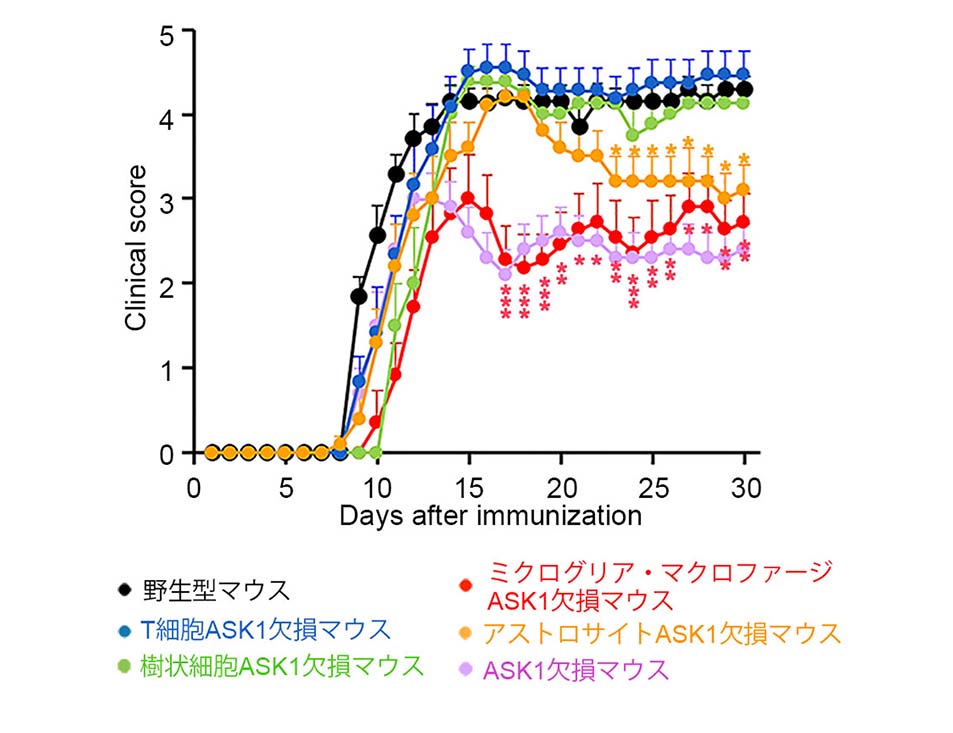
図2: ミクログリアおよびアストロサイト特異的なASK1欠損マウスにおけるEAEの軽症化
野生型マウスのEAE(黒線)と比較して、ミクログリアASK1欠損マウス(赤線)は初期から、アストロサイトASK1欠損マウス(黄線)は後期から大きく軽症化することがわかる。