2022年2月4日
こどもの脳プロジェクトの島田忠之主席研究員らはJohns Hopkins 大学医学部のPaul Worley教授らの研究チームとともに「ファルネシルトランスフェラーゼ阻害剤はRheb1阻害を通じてTsc2+/-マウスの認知障害を回復する」について米国科学誌「The Journal of Neuroscience」に発表しました。
結節性硬化症の新たな治療薬候補を発見
こどもの脳プロジェクトの山形要人客員研究員、島田忠之主席研究員、杉浦弘子再雇用職員らの研究チームは、Johns Hopkins 大学医学部のPaul Worley教授、順天堂大学医学部の小林敏之准教授、樋野興夫客員教授らの研究チームとともに、結節性硬化症モデルマウスを用い、モデルマウスで観察される記憶障害を回復させるメカニズムを見出しました。記憶障害は結節性硬化症において認められる知的障害のモデルと考えられますので、結節性硬化症に伴う知的障害が軽減する可能性が示されました。この発見は、新たな結節性硬化症の治療薬の開発に繋がるものと期待されます。
本研究成果は、2022年2月4日に米国科学誌「The Journal of Neuroscience」にオンライン掲載されました。
- <論文名>
- “A farnesyltransferase inhibitor restores cognitive deficits in Tsc2+/- mice through inhibition of Rheb1”
「ファルネシルトランスフェラーゼ阻害剤はRheb1阻害を通じてTsc2+/-マウスの認知障害を回復する」 - <発表雑誌>
- 米国科学誌「The Journal of Neuroscience」
DOI:10.1523/JNEUROSCI.0449-21.2022
URL:https://www.jneurosci.org/content/early/2022/02/04/JNEUROSCI.0449-21.2022
研究成果のポイント
- 結節性硬化症モデルマウスで観察される樹状突起スパイン*1形態の異常、および神経活動の異常は、低分子量Gタンパク質*2であるRhebの活性化阻害薬を作用させることで回復する。
- 結節性硬化症モデルマウスが示す記憶異常は、Rhebの活性化阻害薬を投与することで回復する。
- 遺伝的にRheb量を減少させたマウスでも記憶異常は回復するため、活性化型Rhebの量が減少することが異常行動の回復に重要であることが示される。
1. 研究の背景
結節性硬化症(tuberous sclerosis complex, TSC)は、血管、脳、腎をはじめとする全身の臓器に過誤腫と呼ばれる良性の腫瘍が形成される難病です。TSC患者は難治性てんかんに加え、知的障害や自閉症等を高率に合併します。TSCの原因遺伝子はTsc1とTsc2であることが知られています。Tsc1、Tsc2は複合体を形成し、低分子量Gタンパク質Rhebを不活性化します。このため、結節性硬化症では活性化型のRhebが増加し、その下流のリン酸化酵素mTORC1*3を中心とした様々なシグナルカスケードが活性化されて症状が発症すると考えられています。一部の腫瘍と難治性てんかんに対しては、mTORC1を阻害するエベロリムスという薬の有効性が確認されており、日本においても認可されていますが、知的障害や自閉症に対する治療法は未だ確立されていませんでした。
2. 研究の内容
本研究グループは過去に、結節性硬化症で見られるシナプス異常は、エベロリムスによるmTROC1の活性阻害ではなく、mTORC1を制御する低分子量Gタンパク質Rhebの活性化抑制により改善することを見出していました(Sci Rep. 2014; Nature Commun. 2015)。そこで、本研究では、mTORC1ではなく、Rhebの機能を薬で抑えることにより、結節性硬化症モデル動物の異常が改善するかどうかを検討しました。Rhebは活性化する際にファルネシル化*4修飾を受けることから、Rhebのファルネシル化を抑えるLonafarnib(ロナファルニブ)をRheb阻害薬として用い、細胞レベル、動物個体レベルの異常が回復するのかを解析しました。
本研究では結節性硬化症モデルマウスとしてTsc2+/-マウスを用いました。このマウスより得た培養神経細胞では樹状突起スパインという構造が、通常のマウスと比較して細長くなることが観察されましたが、培地にロナファルニブを添加することで形態異常の回復が認められました(図1A)。さらに、スパイン上に形成されるシナプス*5もモデルマウスではその数が減少していましたが、ロナファルニブにより数が回復しました。同様の結果は、ロナファルニブを投与したマウスの脳内の神経細胞においても観察されました。これらの結果はロナファルニブが脳内に到達し、神経細胞の形態を調節するメカニズムに作用していることを示唆しています
上述の通り、結節性硬化症においては知的障害が観察されます。同様にモデル動物においても記憶能力が低下することが知られており、知的障害のモデルであると考えられています。Tsc2+/-マウスにロナファルニブを投与することで記憶障害が回復するかを解析すると、記憶の記銘*6前に投与した場合では回復が観察され、記憶の想起前に投与した場合では回復が認められませんでした。また、記憶想起時における神経活動を解析すると、Tsc2+/-マウスでは記憶想起時の神経活動量が低下していましたが、記憶記銘前にロナファルニブを投与すると、想起時の神経活動量が回復していました(図1B)。これらの結果から、ロナファルニブ投与により神経の形態異常が回復することで、Tsc2+/-マウスの記憶記銘能力が回復し、記憶異常が正常化すると考えられました。
さらに、Tsc2+/-マウスの神経細胞におけるRhebの量を遺伝的に減らしたマウスを作成したところ、このマウスでは神経細胞の樹状突起スパインの形態が正常であっただけでなく、記憶異常も観察されませんでした。このマウスではTsc2+/-マウスと比較して活性化型のRheb量が減少したために、異常が回復したものと示唆されます。すなわち、活性化型Rheb量を減らすことが結節性硬化症モデルマウスにおける記憶異常の正常化における重要なポイントであると考えられます。

図1: Tsc2+/-変異マウスにおける神経の変化とロナファルニブ投与の影響
(A) マウス脳内の海馬神経の樹状突起を染色した像。Tsc2+/-変異マウスでは樹状突起スパインと呼ばれる構造が正常マウスと比較して細長くなっている(右上)。ロナファルニブを投与すると正常マウスの様に太くなる(右下)。(B)海馬の神経活動。活動した神経が黒くなるように染色している。赤い線で挟まれた範囲が、海馬における神経細胞群の位置である。正常マウスでは記憶行動により活動する神経が増えて黒く染まる神経の数が増えるが、Tsc2+/-変異マウス十分に数が増えない(右上)。ロナファルニブ投与により数が増えて正常マウス並みになる(右下)。
3. 社会的意義・今後の展望
結節性硬化症の症状は広範にわたるため、エベロリムスが効果を持つ範囲は限定的です。本研究ではロナファルニブにより、Rhebの活性化を阻害することで、結節性硬化症モデルマウスにおける神経細胞の形態異常、機能異常が回復するだけでなく、ロナファルニブによるRhebの活性化阻害はモデルマウスの記憶障害に効果を持つことがわかりました。これらの結果は、活性化型Rhebの増加によりモデルマウスに異常が生じていることを示しています(図2)。モデルマウスの記憶障害は知的障害症状のモデルと考えられていますので、ロナファルニブは結節性硬化症における知的障害の新たな治療薬候補と考えられます。また、Rheb1はてんかん発作によって脳内で増加することも確認しているため、結節性硬化症以外の難治てんかん、あるいはそれに伴う知的障害にも、将来的に適応拡大できる可能性があります。
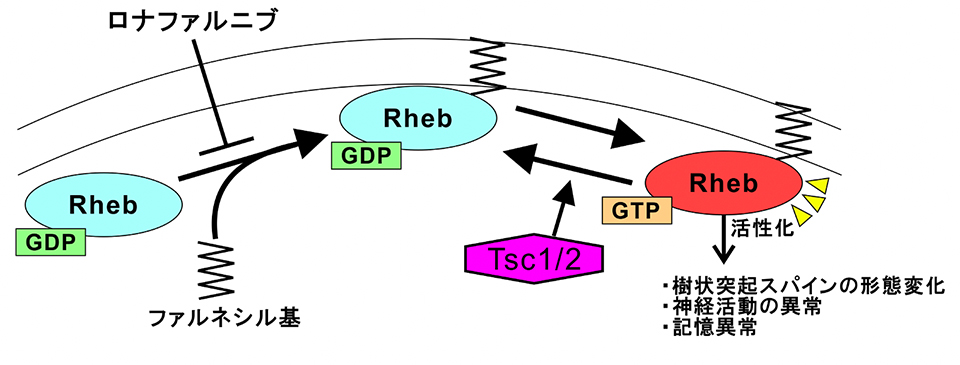
図2: 今回の研究で明らかになった成果の概要
Tsc1/2は複合体を形成し、Rhebを不活性化させるが、Tsc2に変異が入ることでRhebが活性化し、神経細胞の形態変化と活動の異常が生じ、マウスの記憶異常が引き起こされる。ロナファルニブはRhebが活性化するために必要なファルネシル化を阻害することでRhebの活性化を防ぎ、Tsc2変異マウスで観察される神経の形態変化、活動異常を抑え、記憶異常が正常化すると考えられる。用語説明
- *1: 樹状突起スパイン
- 神経細胞には情報の出力の場である軸索という細く長い突起と、情報の入力の場である比較的太い樹状突起と呼ばれる突起がある。樹状突起上には長さが1ミクロン前後でキノコの様に先端が膨らんでいる小さなトゲが多数存在しており、スパインと呼ばれる。
- *2: 低分子量Gタンパク質
- 比較的小さなタンパク質で、GTPと呼ばれる物質が結合しているときには活性化し、GDPと呼ばれる物質が結合しているときには不活性になる。また、それ自身がGTPをGDPに変化させる機能を持っており、変化させる機能を働かせる因子とGDPをGTPに交換する因子の2つにより活性が調節されている。
- *3: mTORC1
- mTOR(mechanistic target of rapamycin)は、細胞外のグルコースやアミノ酸等の栄養源や細胞内エネルギー等の情報を感知して、細胞増殖や代謝を調節するリン酸化酵素。哺乳類では、mTORC1複合体およびmTORC2複合体の2つが存在する。mTORC1は免疫抑制剤のラパマイシンにより阻害される。エベロリムスはラパマイシンの類似物質であり、同様にmTORC1を阻害する。
- *4: ファルネシル化
- 一部のタンパク質は脂質が結合するという修飾を受ける。ファルネシル化はそのうちの1種で、ファルネシル基と呼ばれる脂質が結合するものである。ファルネシル化したタンパク質は、細胞膜やその他の膜構造を持つ細胞内小器官の膜上に移行する。
- *5: シナプス
- 神経細胞の軸索と樹状突起が接触し、情報伝達が行えるように特殊な構造となった部分をシナプスと呼ぶ。軸索側から神経伝達物質と呼ばれる物質が放出され、樹状突起側に存在する受容体がそれと結合することで樹状突起側の神経細胞が活動する。シナプスは樹状突起スパイン上だけでなく、樹状突起に直接形成される場合や神経細胞の細胞体に直接形成されるケースもある。
- *6: 記憶の記銘と想起
- 現在のところ、記憶が成立するためには、覚えるための神経活動(記銘)と思い出すための神経活動(想起)が、それぞれ必要であると考えられている。必要なタイミングで適切な神経活動が行われることが、物事を記憶するために重要である。
<本研究の主な助成事業>
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「難治性疾患実用化研究事業」における研究開発課題「結節性硬化症の知的障害・自閉症に対する新規治療薬の探索」(研究代表者:山形要人)、日本学術振興会(JSPS)科学研究費補助金、てんかん治療研究振興財団、公益財団法人 先進医薬研究振興財団、康本徳守記念研究助成金の支援を受けて行われました。
