2022年4月13日
睡眠プロジェクトの宮川卓 副参事研究員、本多真 副参事研究員らは「オレキシン前駆体遺伝子の切断部位の稀な変異が特発性過眠症と関連する」について英国科学雑誌「npj Genomic Medicine」に発表しました。
特発性過眠症の発症に関与する遺伝子を発見
-オレキシン前駆体遺伝子上の変異が関わることを世界で初めて証明-
当研究所睡眠プロジェクトの 宮川 卓 副参事 研究員、本多 真 副参事研究員らは、国立研究開発法人 国立国際医療研究センター ゲノム医科学プロジェクトの徳永 勝士 プロジェクト長、関西医科大学の田中 進 准教授(現長崎県立大学)らと共同で、「オレキシン前駆体遺伝子の切断部位の稀な変異が特発性過眠症と関連する」を英国科学雑誌「npj Genomic Medicine」に発表しました。
本研究成果は原因が不明であった特発性過眠症の新たな治療につながることが期待されます。
この研究成果は、2022年4月13日(水)に、英国科学雑誌「npj Genomic Medicine」のオンライン版に掲載されました。
- <論文名>
- “A rare genetic variant in the cleavage site of prepro orexin is associated with idiopathic hypersomnia”
(オレキシン前駆体遺伝子の切断部位の稀な変異が特発性過眠症と関連する) - <発表雑誌>
- 英国科学雑誌「npj Genomic Medicine」
DOI:10.1038/s41525-022-00298-w
URL:https://www.nature.com/articles/s41525-022-00298-w
発表のポイント
- 原因不明で、治療も難しい特発性過眠症の発症リスク遺伝子を世界で初めて同定することに成功しました。
- 特発性過眠症の発症リスク遺伝子はオレキシン前駆体遺伝子であり、当該遺伝子上のアミノ酸置換を伴う稀な変異により、特発性過眠症の発症リスクが上昇することを見出しました。
- オレキシン前駆体は切断されることで、オレキシンAとオレキシンBが生成され、睡眠と覚醒を制御します。この変異により、前駆体の切断効率が低下し、オレキシンの受容体を介したシグナル伝達が低下することを明らかにしました。
研究の背景
特発性過眠症は睡眠時間が病的に延長し、覚醒しても日中に強い眠気が持続する病気です。朝も昼寝時も目覚めが非常に悪く、寝ぼけた状態が持続する“睡眠酩酊”を呈し、重症例は長期にわたり一日14-16時間眠ってしまうなど、日常生活に多大な支障をきたします。眠気の軽減に用いられる薬剤が必ずしも効力を発揮しない一方で副作用が生じやすいことも問題です。
特発性過眠症は家族内発症が多く遺伝要因があると考えられてきましたが、これまで発症と関連する遺伝子は明らかにされていませんでした。研究グループでは特発性過眠症の発症リスク遺伝子の同定を目指し、稀な変異を対象とした研究を実施しました。
研究の説明と成果
発症リスク遺伝子を同定するためには、対象疾患を適切に診断し、できる限り多くの患者さんにご参加頂くことが重要です。しかし、特発性過眠症は稀な疾患であり、さらに中枢性過眠症の中でも、その診断が容易ではないことが知られています。そこで、日本全国の睡眠障害の専門医と共同研究体制を構築することで、厳密な診断基準に合致した患者さんを集積し、最終的に598名もの特発性過眠症患者さんのDNAを解析することが可能となりました。これは世界最大のサンプル数となります。
以前、頻度の高い一塩基多型(SNP)を対象とした研究を行いましたが、その際は特発性過眠症と関連する確かな発症リスク遺伝子を同定することができませんでした。そこで、今回は頻度の低い稀な変異を対象とした研究を行うことにしました。まず440名の特発性過眠症患者群と8,380名の対照群について1回目の解析を行った結果、オレキシン前駆体遺伝子上のアミノ酸置換を伴う変異(68番目のリシンがアルギニンに置換)の頻度が、患者群で有意に高いことを明らかにしました。
この結果が偽陽性でないことを証明するために、新たに158名の特発性過眠症患者群と1,446名の対照群について2回目の解析を行いました(1回目で解析された方のDNAは、この2回目の解析には含まれていません)。その結果、2回目の解析においても、この変異の頻度が患者群で有意に高いことが確認されました。二つの解析を統合した結果、患者群におけるこの変異アリルの頻度は1.67%であるのに対し、対照群での変異アリルの頻度は0.32%でした(表1)。さらに、この変異の有無で特発性過眠症の患者さんの睡眠検査や臨床情報の結果を比較したところ、変異を有する患者さんは重症化傾向を示すこともわかりました。
| 変異アリル頻度 (患者群) | 変異アリル頻度 (対照群) | オッズ比 (95%信頼区間) | P値 |
|---|---|---|---|
| 1.67% | 0.32% | 5.36 (3.23-8.91) | 2.7×10-8 |
オレキシン前駆体は切断されることで、オレキシンAとオレキシンBが生成されます。このオレキシンAとオレキシンBが、2種類のオレキシン受容体を介して、睡眠と覚醒を調整することが知られています。同定した変異は、オレキシン前駆体が切断される部位に位置していました。そこで、変異体と野生型(変異無)のオレキシン前駆体ペプチド断片で、切断酵素(プロホルモン変換酵素1とプロホルモン変換酵素2)による切断の程度に違いが見られるか検討しました。その結果、野生型に比べて、変異体のオレキシン前駆体ペプチド断片は、切断される割合が低いことがわかりました(図1)。
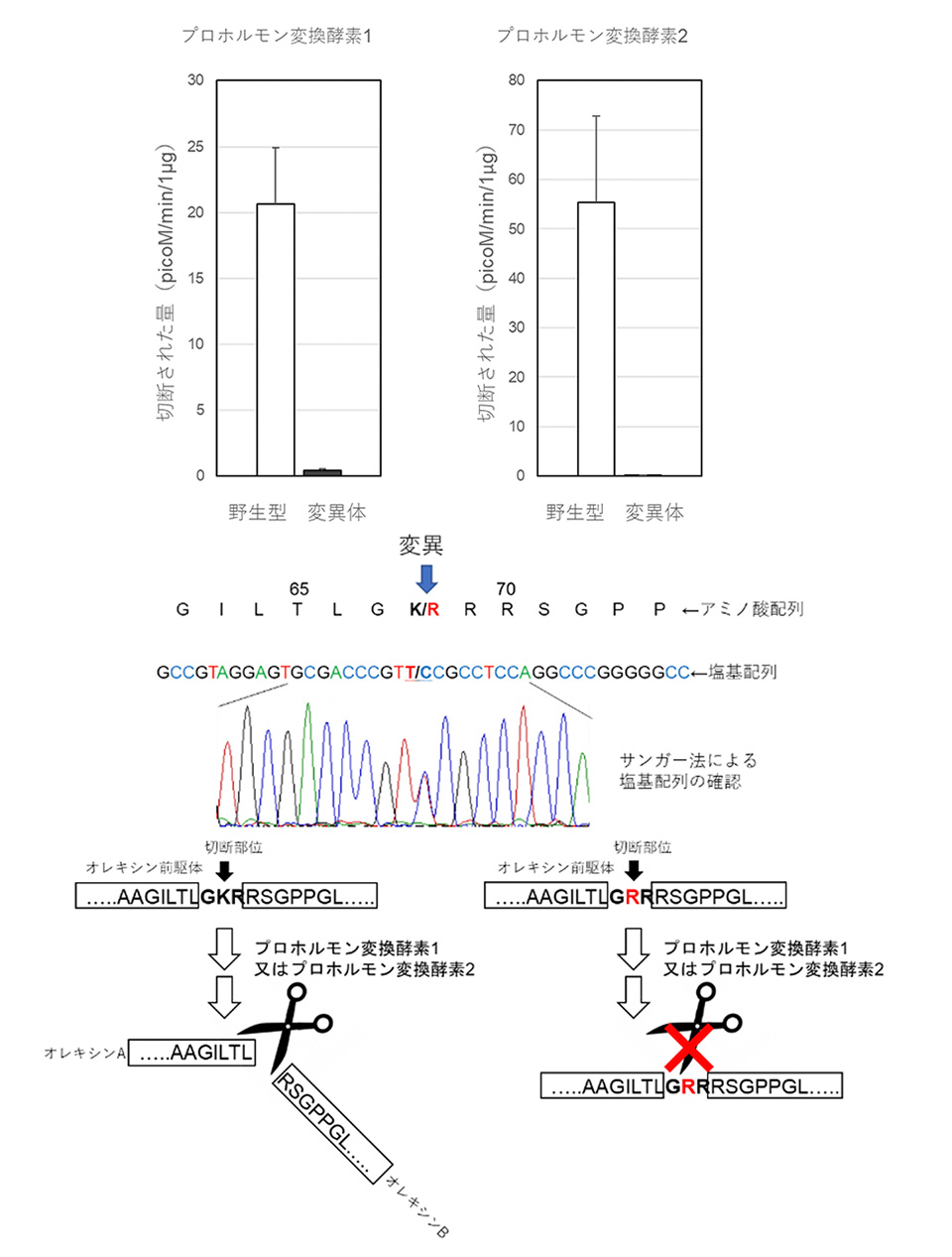
図1:
変異体と野生型のオレキシン前駆体ペプチド断片における切断効率の結果、変異体では、切断される割合が低いことがわかりました(上図)。この変異により、オレキシンAとオレキシンBが適切に生成されないことが示唆されます(下図)。次に、切断されなくてもオレキシン前駆体ペプチドが、オレキシン受容体に対して、薬理活性を持つ可能性もあります。そこで、2種類のオレキシン受容体に対する、オレキシン前駆体ペプチド、オレキシンA及びオレキシンBの薬理活性の違いについても、細胞レベルで検討しました。その結果、オレキシン前駆体ペプチドは、薬理活性が低いことを確認しました(図2)。統合すると、特発性過眠症と関連するこの変異によって、オレキシンシグナリングに異常が生じることが示唆されます(図3)。
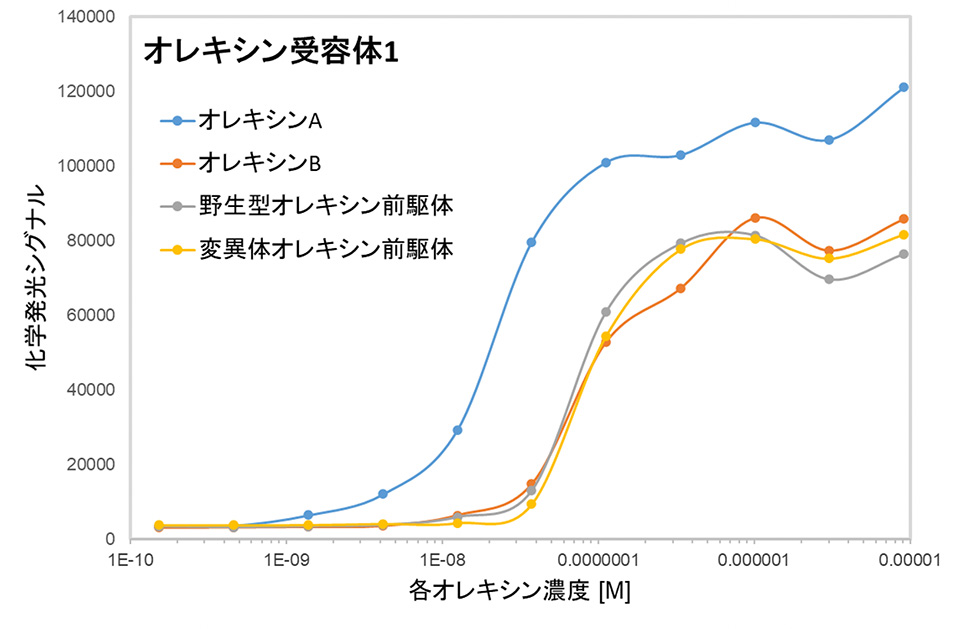
図2:
オレキシン前駆体ペプチドのままでは、オレキシン受容体を介した薬理活性が低いことを確認しました(OX1R:オレキシン受容体1、OX2R:オレキシン受容体2)。このグラフではオレキシン受容体1の結果を示します。Y軸の化学発光シグナルの値は薬理活性の高さを示します。X軸は各オレキシンの濃度を示し、左から右に行くほど、濃度が濃いことになります。各オレキシンの希釈濃度を変えて測定することで、どのぐらいの濃度で薬理作用を示すか調べます。オレキシン前駆体ペプチドやオレキシンBはオレキシン受容体1に対して、オレキシンAより濃い濃度でシグナルが検出されており、オレキシンAより薬理活性が低いことがわかります。オレキシン受容体2の実験も行い、オレキシンAとBに比べて、オレキシン前駆体ペプチドは薬理活性が低いことを確認しました。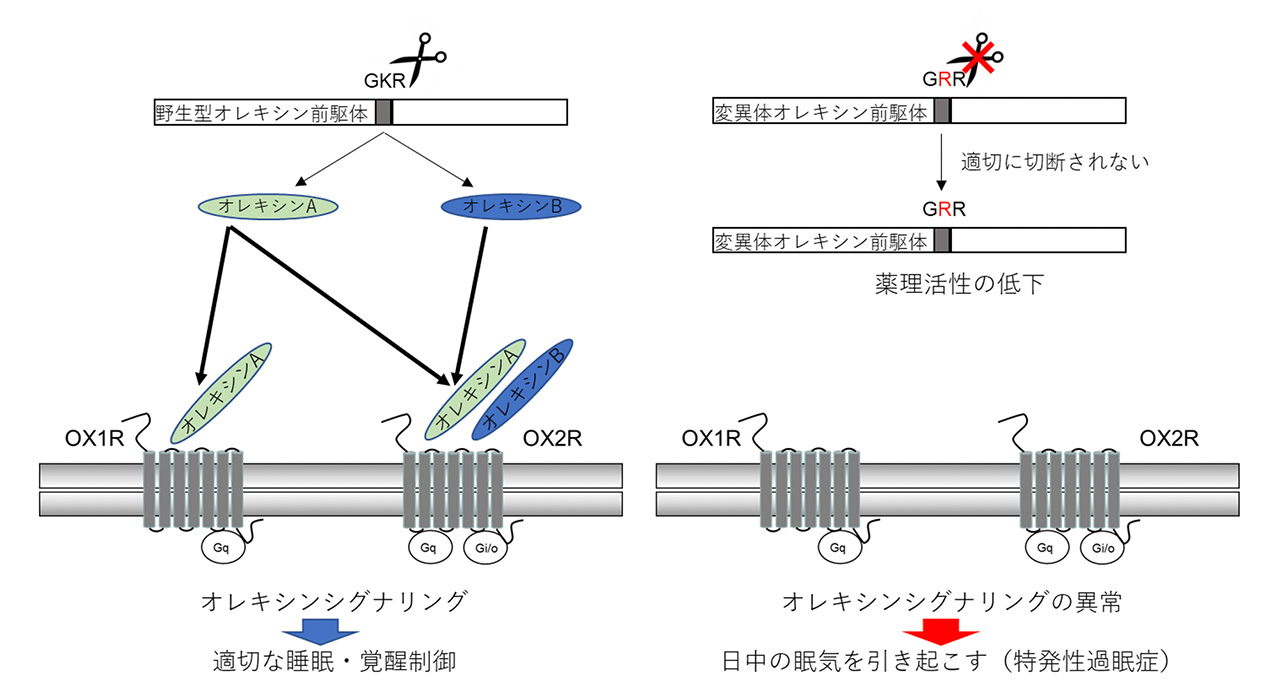
図3: 同定した変異の機能的影響に関する概要図
この研究成果が社会に与える影響
特発性過眠症は、その病名の通り、原因不明の過眠症です。さらに、その異質性の高さから、特発性過眠症の研究はほとんど実施されてきませんでした。そのような状況にも関わらず、本研究によって特発性過眠症の発症リスク遺伝子を世界で初めて発見することに成功しました。オレキシン系の異常はナルコレプシー(代表的な中枢性過眠症)に特異的なものと考えられていましたが、特発性過眠症の一部の群にも変異を介してオレキシン系の異常が関与することを明らかにしました。現在複数の製薬会社がナルコレプシー治療薬としてオレキシン作動薬を開発中です。今回同定した変異を有する特発性過眠症患者にも、このオレキシン作動薬が有効である可能性があり、将来的な個別化医療に貢献する研究成果となります。
本研究の主な助成事業
本研究は、AMED難治性疾患実用化研究事業(希少難治性疾患の克服に結びつく独創的な病態解明研究)・日本学術振興会(JSPS)科学研究費 基盤研究B及び基盤研究C・武田科学振興財団研究助成金の支援を受けて行われました。
